Diklorometana (CH2Cl2) atau metilen klorida melarutkan berbagai macam senyawa organik dan umumnya digunakan sebagai pelarut di laboratorium kimia. Ini juga dapat digunakan dalam proses pengupasan dan penghilangan lemak cat.
| Nama IUPAC | Diklorometana |
| Formula molekul | CH2Cl2 |
| nomor CAS | 75-09-2 |
| Sinonim | Metilen Klorida, Metilen Diklorida, DCM, Narkotil, Solaesthin, Solmethine, dll. |
| Di ChI | InChI=1S/CH2Cl2/c2-1-3/h1H2 |
Kepadatan Diklorometana g/ml
Massa jenis diklorometana adalah 1,326 g/mL. Nilai ini menunjukkan massa diklorometana per satuan volume pada suhu dan tekanan tertentu. Kepadatan diklorometana relatif tinggi, menjadikannya cairan yang lebih padat dibandingkan air. Sifat ini membuatnya berguna dalam beberapa aplikasi laboratorium, dimana dapat digunakan untuk memisahkan zat dengan kepadatan berbeda.
Titik didih diklorometana
Titik didih diklorometana adalah 39,6°C (103,3°F). Suhu ini menunjukkan titik di mana bentuk cair diklorometana akan berubah menjadi gas. Titik didih diklorometana yang rendah menjadikannya senyawa yang sangat mudah menguap dan mudah menguap pada suhu kamar. Properti ini membuatnya berguna sebagai pelarut di banyak aplikasi laboratorium, dimana dapat dengan mudah diuapkan.
Massa Molar Diklorometana
Massa molar diklorometana, juga disebut metilen klorida, adalah 84,93 g/mol. Nilai ini diperoleh dengan menjumlahkan massa atom atom dari satu molekul diklorometana. Rumus molekul diklorometana adalah CH2Cl2, yang menunjukkan bahwa ia mengandung satu atom karbon, dua atom hidrogen, dan dua atom klor. Massa molar adalah properti penting untuk menentukan jumlah suatu zat yang ada dalam sampel tertentu.
Titik Leleh Diklorometana
Titik leleh CH2Cl2 adalah -97,4°C (-143,3°F). Suhu ini menunjukkan titik di mana bentuk padat CH2Cl2 akan berubah menjadi cair. Namun, CH2Cl2 jarang ditemukan dalam bentuk padat, karena merupakan cairan yang mudah menguap pada suhu kamar. Titik leleh CH2Cl2 yang rendah membuat CH2Cl2 sulit dibekukan dan tetap cair bahkan pada suhu rendah.
Berat Molekul Diklorometana
Berat molekul CH2Cl2 adalah 84,93 g/mol. Nilai ini merupakan jumlah dari berat atom atom-atom dalam satu molekul CH2Cl2. Berat molekul merupakan sifat penting untuk menentukan jumlah suatu zat yang ada dalam sampel tertentu.
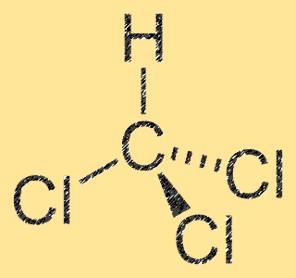
Struktur diklorometana
CH2Cl2 memiliki struktur molekul tetrahedral, dengan atom karbon pusat terikat pada dua atom klor dan dua atom hidrogen. Molekul tersebut memiliki momen dipol, yang disebabkan oleh perbedaan keelektronegatifan antara atom karbon dan klor. Atom karbon mempunyai muatan parsial positif, sedangkan atom klor mempunyai muatan parsial negatif. Sifat ini membuat CH2Cl2 menjadi molekul polar.
Rumus diklorometana
Rumus molekul diklorometana adalah CH2Cl2. Rumusnya menunjukkan bahwa molekul tersebut mengandung satu atom karbon, dua atom hidrogen, dan dua atom klor. Rumusnya juga memberikan informasi tentang jumlah relatif atom dalam satu molekul diklorometana. Rumusnya berguna untuk menentukan stoikiometri reaksi kimia yang melibatkan diklorometana.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1.326 |
| Warna | Tanpa warna |
| Bau | Baunya ringan, mirip dengan kloroform |
| Masa molar | 84,93 g/mol |
| Kepadatan | 1,326 gram/mL |
| Titik fusi | -97,4°C (-143,3°F) |
| Titik didih | 39,6°C (103,3°F) |
| Titik kilat | -22°C (-8°F) |
| Kelarutan dalam air | 16,5 g/L pada 20°C (68°F) |
| Kelarutan | Dapat larut dengan banyak pelarut organik |
| Tekanan uap | 44,6 kPa pada 20°C (68°F) |
| Kepadatan uap | 2.93 |
| pKa | 4 |
| pH | Netral |
Keamanan dan bahaya diklorometana
Diklorometana (CH2Cl2), juga dikenal sebagai metilen klorida, adalah bahan kimia berbahaya yang menimbulkan risiko keselamatan signifikan jika tidak ditangani dengan benar. Bahan ini sangat mudah terbakar dan dapat menyebabkan kebakaran atau ledakan jika terkena panas atau nyala api terbuka. Menghirup uapnya dapat menyebabkan iritasi pernafasan, sakit kepala, pusing bahkan kehilangan kesadaran. Kontak kulit dengan CH2Cl2 dapat menyebabkan iritasi, luka bakar atau luka bakar kimia. Ini juga berpotensi menjadi karsinogen, dan paparan jangka panjang akan meningkatkan risiko kanker hati dan paru-paru. Tindakan pencegahan keselamatan yang tepat, seperti menggunakan alat pelindung diri yang sesuai dan bekerja di area yang berventilasi baik, sangat penting saat bekerja dengan CH2Cl2.
| Simbol bahaya | Xn,F |
| Deskripsi Keamanan | Cairan dan uap yang sangat mudah terbakar. Berbahaya jika tertelan, terhirup atau terserap melalui kulit. Menyebabkan iritasi kulit dan iritasi mata yang serius. Dapat menyebabkan iritasi pernafasan. Dapat menyebabkan kantuk atau pusing. Mungkin berakibat fatal jika tertelan dan memasuki saluran pernapasan. |
| Sebuah pengidentifikasi | PBB 1593 |
| kode HS | 29031200 |
| Kelas bahaya | 3 |
| Kelompok pengepakan | II |
| Toksisitas | Diklorometana diklasifikasikan sebagai karsinogen Kategori 2 dan telah dikaitkan dengan kanker hati dan paru-paru. Ia juga diketahui menyebabkan depresi sistem saraf pusat dan bisa berakibat fatal jika tertelan atau terhirup dalam konsentrasi tinggi. Tindakan pencegahan keselamatan yang tepat harus selalu dilakukan saat bekerja dengan diklorometana. |
Metode sintesis diklorometana
Ada beberapa metode untuk mensintesis diklorometana (CH2Cl2), cairan tidak berwarna yang digunakan sebagai pelarut dan pengupas cat. Metode yang umum melibatkan reaksi gas metana dengan gas klor dengan adanya katalis, biasanya aluminium klorida atau besi klorida. Reaksi ini menghasilkan gas CH2Cl2 dan hidrogen klorida sebagai produk sampingan. Metode lain melibatkan klorinasi metanol dengan gas hidrogen klorida atau tionil klorida. Reaksi ini juga menghasilkan produk CH2Cl2, serta air atau sulfur dioksida sebagai produk samping.
Metode lain melibatkan reaksi kloroform dengan seng dengan adanya asam klorida. Reaksi ini menghasilkan produk CH2Cl2 dan seng klorida, dengan gas hidrogen sebagai produk sampingan.
Klorinasi berbagai senyawa organik, seperti etana atau propana, dengan adanya katalis dapat menghasilkan CH2Cl2 sebagai produk sampingan.
Terlepas dari metode yang digunakan, penting untuk menangani CH2Cl2 dengan hati-hati karena sifatnya yang berbahaya. Saat mensintesis dan menangani CH2Cl2, penting untuk mengambil tindakan pencegahan keselamatan yang tepat, seperti memakai alat pelindung diri yang sesuai dan bekerja di area yang berventilasi baik.
Kegunaan diklorometana
Diklorometana, juga dikenal sebagai metilen klorida, banyak digunakan dalam industri dan penelitian sebagai pelarut organik serbaguna. Ini memainkan peran penting dalam produksi obat-obatan dan pelapis seperti cat dan pernis. Selain itu, ini adalah bahan pembersih yang berguna dalam industri manufaktur elektronik dan metalurgi untuk menghilangkan lemak.
Diklorometana melarutkan dan menghilangkan berbagai jenis cat dan pelapis, menjadikannya pengupas yang populer. Yang juga patut diperhatikan adalah penggunaannya sebagai bahan peniup dalam produksi busa poliuretan, resin polikarbonat, dan plastik lainnya.
Selain kegunaan industrinya, diklorometana juga berharga dalam ekstraksi produk alami seperti minyak esensial dan parfum dari bahan tanaman. Ini juga merupakan pelarut efektif untuk banyak senyawa organik yang digunakan dalam reagen laboratorium dalam sintesis organik.
Namun, diklorometana memerlukan penanganan yang hati-hati karena sifatnya yang berbahaya seperti mudah terbakar dan beracun. Penting untuk mengambil tindakan pencegahan keselamatan yang tepat, termasuk bekerja di area yang berventilasi baik dan mengenakan alat pelindung diri yang sesuai saat bekerja dengan diklorometana.
Pertanyaan:
T: Apakah diklorometana bersifat polar?
J: Ya, diklorometana adalah pelarut polar.
T: Risiko manakah di bawah ini yang berhubungan dengan diklorometana?
J: Bahaya yang terkait dengan diklorometana mencakup sifat mudah terbakar, toksisitas, dan potensi iritasi kulit dan pernapasan.
T: Apakah diklorometana mudah terbakar?
J: Ya, diklorometana mudah terbakar dan dapat menyebabkan kebakaran atau ledakan jika terkena panas atau nyala api terbuka.
T: Apakah diklorometana larut dalam air?
A: Ya, diklorometana sedikit larut dalam air. Namun, ia terutama digunakan sebagai pelarut untuk senyawa nonpolar dan tidak umum digunakan dalam larutan air.
