Klorin (Cl2) merupakan gas berwarna kuning kehijauan yang sangat reaktif. Ini digunakan dalam pengolahan air, sebagai desinfektan dan dalam produksi berbagai bahan kimia, seperti PVC dan pelarut.
| Nama IUPAC | Diklor |
| Formula molekul | Cl2 |
| nomor CAS | 7782-50-5 |
| Sinonim | Klorin molekul, Klorin, Kloro, Klor, Klor, Kloro de cloro |
| Di ChI | InChI=1S/Cl2/c1-2 |
Cl2 Massa molar
Massa molar Cl2, atau klor, adalah jumlah massa atom dua atom klor, atau 70,906 g/mol. Penting untuk mengetahui massa molar Cl2 ketika menghitung jumlah zat yang dibutuhkan untuk reaksi kimia atau ketika mengkonversi antara satuan pengukuran yang berbeda.
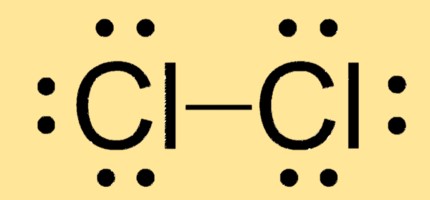
Struktur Lewis Cl2
Cl2 memiliki geometri molekul linier dengan dua atom klor dihubungkan oleh ikatan kovalen tunggal. Struktur Lewisnya terdiri dari dua atom Cl yang masing-masing memiliki tiga pasangan elektron bebas dan satu pasangan elektron yang digunakan bersama di antara keduanya.
Titik didih Cl2
Titik didih Cl2 adalah -34,04°C (-29,27°F) pada tekanan standar. Ini adalah titik didih yang relatif rendah, yang menghasilkan gas Cl2 pada suhu dan tekanan kamar. Penting untuk berhati-hati saat menangani Cl2, karena Cl2 dapat dengan mudah berubah menjadi cair atau padat pada suhu dan tekanan rendah.
Cl2 Titik leleh
Titik leleh Cl2 adalah -101,5°C (-150,7°F) pada tekanan standar. Ini adalah titik leleh yang relatif rendah, yang menghasilkan gas Cl2 pada suhu dan tekanan kamar. Penting untuk berhati-hati saat menangani Cl2, karena Cl2 dapat dengan mudah berubah menjadi cair atau padat pada suhu dan tekanan rendah.
Kepadatan Cl2 gram/ml
Massa jenis Cl2 adalah 0,003214 g/mL pada suhu dan tekanan standar (STP). Ini berarti Cl2 memiliki massa jenis yang jauh lebih kecil dibandingkan udara dan akan naik ke atmosfer. Cl2 dapat disimpan dalam silinder bertekanan atau dalam tangki yang berisi gas yang lebih berat dari udara seperti nitrogen.
Berat molekul klorin
Berat molekul Cl2 adalah 70,906 g/mol. Ini adalah massa satu mol Cl2, yang mengandung jumlah molekul Avogadro (6,022 x 10^23). Berat molekul Cl2 penting untuk perhitungan stoikiometri dalam kimia.
Struktur klorin
Struktur Cl2 adalah linier, dengan dua atom klor dihubungkan oleh ikatan kovalen. Panjang ikatan antara dua atom klor adalah 1,99 Ångstrom dan energi ikatannya adalah 242 kJ/mol. Konfigurasi elektronik Cl2 adalah [Ne]3s23p5, dengan setiap atom klor menyumbang satu elektron pada pasangan ikatan.
rumus klorin
Rumus Cl2 hanyalah dua atom Cl yang terikat bersama. Ini diwakili oleh Cl-Cl atau Cl2. Rumusnya penting untuk mengidentifikasi komposisi suatu senyawa atau molekul dan untuk perhitungan stoikiometri dalam kimia.
| Penampilan | Gas berwarna kuning kehijauan |
| Berat jenis | 1,56 (cair) |
| Warna | kuning kehijauan |
| Bau | Bau yang menyengat dan menyesakkan |
| Masa molar | 70,906 g/mol |
| Kepadatan | 0,003214 g/mL pada STP |
| Titik fusi | -101,5°C (-150,7°F) |
| Titik didih | -34,04°C (-29,27°F) |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 0,92 g/100 mL pada 20°C |
| Kelarutan | Larut dalam air, etanol, eter, benzena dan banyak pelarut organik |
| Tekanan uap | 102,44 kPa pada 20°C |
| Kepadatan uap | 2,49 (udara = 1) |
| pKa | – |
| pH | – |
Cl2 Keamanan dan bahaya
Klorin adalah gas yang sangat reaktif yang dapat menimbulkan risiko keselamatan dan kesehatan yang serius jika tidak ditangani dengan benar. Hal ini dapat menyebabkan iritasi pernafasan yang serius dan kerusakan pada mata, kulit dan selaput lendir. Menghirup klorin dalam konsentrasi tinggi dapat menyebabkan edema paru, yang dapat mengancam jiwa. Klorin juga sangat korosif dan dapat merusak logam, plastik, dan bahan lainnya. Untuk memastikan penanganan klorin yang aman, peralatan pelindung diri yang sesuai harus dipakai, seperti kacamata, sarung tangan, dan respirator. Klorin hanya boleh digunakan di area yang berventilasi baik dan semua wadah harus diberi label dengan benar dan disimpan di lokasi yang aman.
| Simbol bahaya | Tengkorak dan tulang bersilang |
| Deskripsi Keamanan | Gas yang sangat beracun dan korosif; menyebabkan iritasi pernafasan dan kulit yang parah; dapat berakibat fatal jika terhirup dalam konsentrasi tinggi |
| Nomor identifikasi PBB | UN1017 |
| kode HS | 2801.1 |
| Kelas bahaya | 2.3 |
| Kelompok pengepakan | SAYA |
| Toksisitas | Sangat beracun; menghirup konsentrasi tinggi dapat menyebabkan edema paru dan berakibat fatal |
Metode sintesis klorin
Ada berbagai metode untuk mensintesis gas klor, termasuk elektrolisis air garam, oksidasi HCl, dan dekomposisi termal logam klorida.
Metode yang paling umum adalah elektrolisis air garam, yang melibatkan aliran arus listrik melalui larutan natrium klorida (NaCl) dan air (H2O). Proses ini menghasilkan gas klor di anoda dan gas hidrogen di katoda.
Metode lain untuk memproduksi klorin adalah oksidasi HCl dengan zat pengoksidasi, seperti KMnO4 atau MnO2. Reaksi ini menghasilkan gas klor dan air sebagai produk sampingan.
Dekomposisi termal logam klorida, seperti MgCl2 atau FeCl3, adalah metode lain untuk menghasilkan gas klor. Proses ini melibatkan pemanasan logam klorida hingga suhu tinggi, yang menyebabkannya terurai dan melepaskan gas klor.
Secara keseluruhan, metode sintesis yang digunakan untuk klorin bergantung pada aplikasi spesifik dan kemurnian gas yang diinginkan. Apapun metode yang digunakan, penting untuk menangani klorin dengan hati-hati karena sifatnya yang sangat reaktif dan beracun.
Kegunaan klorin
Gas klorin memiliki kegunaan yang luas di berbagai industri. Salah satu kegunaan utama klorin adalah produksi polivinil klorida (PVC), bahan plastik yang banyak digunakan. Klorin juga digunakan dalam produksi senyawa klor lainnya, seperti kloroform dan karbon tetraklorida, yang digunakan sebagai pelarut dan dalam pembuatan zat pendingin.
Dalam industri pengolahan air, klorin umumnya digunakan sebagai desinfektan untuk mengolah air minum dan air limbah. Gas klorin efektif membunuh bakteri dan virus, serta dapat mengoksidasi dan menghilangkan senyawa organik dan kontaminan lainnya dari air.
Dalam industri pulp dan kertas, gas klor digunakan sebagai bahan pemutih untuk memutihkan produk kertas. Ia juga digunakan dalam produksi tekstil, seperti nilon dan poliester, serta dalam pembuatan pewarna dan pigmen.
Gas klor juga mempunyai kegunaan lain, terutama dalam produksi produk farmasi tertentu dan dalam industri metalurgi untuk pengupasan dan pembersihan permukaan logam. Namun, karena sifatnya yang berbahaya, klorin harus ditangani dengan hati-hati dan tindakan pencegahan keselamatan yang tepat harus dilakukan selama penyimpanan, pengangkutan, dan penggunaannya.
Pertanyaan:
Q: Apakah Cl2 polar atau non-polar?
Jawaban: Cl2 adalah molekul non-polar.
T: Apakah klorin termasuk logam?
J: Tidak, klorin bukanlah logam. Ini adalah halogen dan termasuk dalam kelompok unsur non-logam.
T: Logam lunak apa yang digabungkan dengan klorin untuk menghasilkan garam meja?
A: Natrium (Na) adalah logam lunak yang bergabung dengan klorin (Cl) menghasilkan garam meja (NaCl).
T: Bagaimana cara mengklorinasi air?
J: Klorinasi air umumnya dilakukan dengan menambahkan sejumlah gas klor, natrium hipoklorit, atau kalsium hipoklorit ke dalam persediaan air. Jumlah klorin yang ditambahkan tergantung pada kualitas air dan tingkat desinfeksi yang diinginkan. Klorin bereaksi dengan bakteri dan mikroorganisme lain di dalam air, secara efektif membunuh bakteri dan membuat air aman untuk diminum.
T: Manakah dari bahan berikut yang diolah dengan klorin untuk mendapatkan bubuk pemutih?
A: Kalsium oksida (CaO) diolah dengan klorin (Cl2) untuk mendapatkan bubuk pemutih (CaOCl2).
