Barium hidroksida adalah senyawa kimia dengan rumus Ba(OH)2. Ini adalah padatan kristal putih yang sangat larut dalam air dan biasa digunakan di laboratorium dan proses industri.
| Nama IUPAC | Barium dihidroksida |
| Formula molekul | Ba(OH)2 |
| nomor CAS | 17194-00-2 |
| Sinonim | Barium (II) hidroksida, barit, barium hidrat, barium dihidrat, bis (barium hidroksida), bis (oksidanil) barium hidrat |
| Di ChI | InChI=1S/Ba.2H2O/jam;2*1H2/q+2;;/p-2 |
Massa molar barium hidroksida
Barium hidroksida memiliki massa molar 171,34 g/mol. Ia terdiri dari satu ion barium (Ba2+) dan dua ion hidroksida (OH-), masing-masing memiliki massa molar masing-masing 137,33 g/mol dan 17,01 g/mol. Massa molar barium hidroksida penting untuk menentukan jumlah senyawa yang dibutuhkan untuk reaksi atau untuk menghitung konsentrasi suatu larutan.
Rumus Barium Hidroksida
Rumus kimia barium hidroksida adalah Ba(OH)2. Terdiri dari satu ion barium (Ba2+) dan dua ion hidroksida (OH-). Rumus barium hidroksida penting untuk menentukan jumlah senyawa yang dibutuhkan dalam reaksi atau untuk menghitung konsentrasi suatu larutan. Ini juga digunakan untuk mewakili struktur senyawa dan perilakunya dalam larutan.
Titik didih Ba(OH)2
Titik didih Ba(OH)2 tidak dapat ditentukan dengan jelas, karena ia terurai sebelum direbus. Ba(OH)2 merupakan basa kuat dan mudah bereaksi dengan karbon dioksida di udara, membentuk barium karbonat dan air. Suhu penguraian Ba(OH)2 bergantung pada konsentrasi larutan, tetapi umumnya di atas 780°C.
titik leleh Ba(OH)2
Ba(OH)2 memiliki titik leleh 407°C. Itu ada dalam keadaan padat dalam bentuk kristal putih dan tidak berbau. Ketika dipanaskan, Ba(OH)2 mengalami reaksi reversibel membentuk barium oksida dan air. Titik leleh Ba(OH)2 penting dalam menentukan suhu dimana Ba(OH)2 dapat ditangani dan disimpan dengan aman.
Massa jenis Ba(OH)2 g/ml
Massa jenis padatan Ba(OH)2 adalah 3,22 g/cm3. Dalam larutan, densitasnya bervariasi tergantung konsentrasinya. Misalnya, larutan Ba(OH)2 10% mempunyai massa jenis 1,17 g/cm3. Massa jenis Ba(OH)2 penting dalam menentukan volume larutan yang diperlukan untuk reaksi atau saat menangani senyawa.
berat molekul Ba(OH)2
Berat molekul Ba(OH)2 adalah 171,34 g/mol. Ini adalah jumlah berat atom dari satu ion barium dan dua ion hidroksida. Berat molekul Ba(OH)2 penting untuk menentukan jumlah senyawa yang dibutuhkan dalam reaksi atau untuk menghitung konsentrasi suatu larutan.
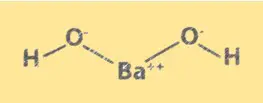
Struktur Ba(OH)2
Ba(OH)2 memiliki struktur kristal yang mirip dengan natrium klorida. Terdiri dari ion Ba2+ dan ion OH-, tersusun dalam kisi kubik. Ion Ba2+ menempati sudut-sudut kubus dan ion OH- menempati bagian tengah setiap permukaan kubus. Struktur Ba(OH)2 penting untuk memahami sifat kimia dan perilakunya dalam larutan.
| Penampilan | Padatan kristal putih |
| Berat jenis | 3,22 g/cm3 (padat) |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 171,34 g/mol |
| Kepadatan | 2,18 g/cm3 (larutan berair, 10% b/b pada 25°C) |
| Titik fusi | 407°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut dalam air |
| Kelarutan | Larut dalam alkohol dan aseton |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Basa (pH > 7) |
Catatan: Nilai yang diberikan dalam tabel ini adalah gambaran umum dan dapat bervariasi tergantung pada kondisi spesifik dan konsentrasi zat.
Keamanan dan Bahaya Barium Hidroksida
Ba(OH)2 merupakan zat yang sangat kaustik dan beracun yang dapat menyebabkan iritasi parah pada kulit, mata, dan saluran pernapasan. Penting untuk menanganinya dengan hati-hati dan memakai alat pelindung diri yang sesuai, seperti sarung tangan dan kacamata pengaman. Jika terhirup atau tertelan, dapat menyebabkan kerusakan serius pada paru-paru, sistem pencernaan, dan ginjal. Ini harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel seperti asam dan oksidan. Jika terjadi tumpahan atau paparan, ikuti prosedur darurat yang sesuai, seperti mengevakuasi area tersebut dan segera mencari pertolongan medis.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata; Kenakan pakaian pelindung dan sarung tangan; Gunakan hanya di area yang berventilasi baik |
| Sebuah pengidentifikasi | PBB 1564 |
| kode HS | 2816.40.00 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan, terhirup dan terserap melalui kulit; Menyebabkan iritasi serius pada kulit dan mata; Dapat menyebabkan iritasi saluran pernapasan dan kerusakan ginjal |
Metode sintesis barium hidroksida
Ba(OH)2 dapat disintesis dengan beberapa metode, antara lain reaksi barium oksida (BaO) dengan air (H2O) atau reaksi barium klorida (BaCl2) dengan natrium hidroksida (NaOH).
Pada metode pertama, barium oksida ditambahkan perlahan ke dalam air suling sambil diaduk terus-menerus hingga konsentrasi yang diinginkan tercapai. Larutan yang dihasilkan kemudian disaring dan dikeringkan hingga diperoleh bentuk padat Ba(OH)2.
Pada metode kedua, larutan barium klorida ditambahkan perlahan ke dalam larutan natrium hidroksida sambil diaduk terus-menerus hingga pH yang diinginkan tercapai. Larutan yang dihasilkan kemudian disaring dan dikeringkan hingga diperoleh bentuk padat Ba(OH)2.
Metode lain melibatkan reaksi barium sulfida (BaS) dengan air, menghasilkan Ba(OH)2 dan gas hidrogen sulfida (H2S).
Ba(OH)2 juga dapat dibuat dengan elektrolisis garam barium cair atau dengan dekomposisi termal barium karbonat (BaCO3) pada suhu tinggi.
Secara keseluruhan, sintesis Ba(OH)2 memerlukan penanganan yang hati-hati dan tindakan pencegahan keselamatan yang tepat karena sifatnya yang sangat kaustik dan toksik. Penting untuk mengikuti protokol dan peraturan keselamatan yang tepat saat bekerja dengan bahan berbahaya.
Kegunaan Barium Hidroksida
Ba(OH)2 memiliki beberapa kegunaan industri dan laboratorium karena sifatnya yang sangat reaktif dan bersifat basa. Salah satu kegunaan utamanya adalah sebagai reagen kimia dalam produksi berbagai bahan kimia, termasuk pelumas, plastik, dan pestisida.
Ba(OH)2 juga digunakan sebagai penstabil pada PVC dan plastik lainnya untuk mencegah perubahan warna dan degradasi akibat panas dan paparan sinar UV. Hal ini juga digunakan dalam produksi jenis kaca tertentu, seperti kaca optik dan kaca indeks bias tinggi.
Di laboratorium, Ba(OH)2 digunakan sebagai katalis dalam berbagai reaksi organik, seperti reaksi esterifikasi dan transesterifikasi. Ia juga digunakan sebagai titran dalam kimia analitik untuk penentuan asam lemah dan dalam pembuatan larutan standar.
Aplikasi lain dari Ba(OH)2 adalah produksi barium oksida, yang digunakan dalam pembuatan tabung sinar katoda untuk televisi dan monitor komputer.
Ba(OH)2 juga digunakan dalam pengolahan air limbah industri untuk menghilangkan kotoran dan menetralkan limbah asam atau basa sebelum dibuang ke lingkungan.
Secara keseluruhan, Ba(OH)2 memainkan peran penting di banyak industri dan laboratorium, berkontribusi terhadap produksi banyak produk dan proses.
Pertanyaan:
Apakah barium hidroksida larut?
Ya, barium hidroksida larut dalam air. Ketika dilarutkan dalam air, ia membentuk larutan basa dengan pH sekitar 12,5. Kelarutan Ba(OH)2 dalam air relatif tinggi, dengan kelarutan sekitar 3,52 g/100 mL pada suhu kamar (25 °C). Kelarutan Ba(OH)2 dapat dipengaruhi oleh beberapa faktor seperti suhu, tekanan dan keberadaan zat lain dalam larutan.
Apakah barium hidroksida merupakan basa kuat?
Ya, barium hidroksida adalah basa kuat. Ketika dilarutkan dalam air, ia akan terdisosiasi sempurna membentuk ion barium (Ba2+) dan ion hidroksida (OH-) dalam larutan. Disosiasi ini menghasilkan larutan yang sangat basa dengan pH sekitar 12,5. Sifat basa yang kuat dari Ba(OH)2 menjadikannya penetral limbah asam yang efektif dan katalis dalam berbagai reaksi organik.
Apa rumus barium hidroksida?
Rumus barium hidroksida adalah Ba(OH)2. Rumus ini menunjukkan bahwa setiap molekul barium hidroksida mengandung satu ion barium (Ba2+) dan dua ion hidroksida (OH-). Ion barium bermuatan +2, sedangkan ion hidroksida bermuatan -1. Dua ion hidroksida dalam Ba(OH)2 menyeimbangkan muatan +2 ion barium untuk menghasilkan senyawa netral. Rumus Ba(OH)2 penting untuk memahami sifat dan reaksinya, serta untuk menghitung massa molar dan sifat fisikokimia lainnya.
