Barium klorida dihidrat adalah senyawa kristal putih dengan rumus kimia BaCl2·2H2O. Ini biasanya digunakan di laboratorium sebagai reagen dan industri untuk perawatan permukaan logam.
| Nama IUPAC | Barium klorida dihidrat |
| Formula molekul | BaCl2·2H2O |
| nomor CAS | 10326-27-9 |
| Sinonim | Barium diklorida dihidrat; Barium(II) klorida dihidrat; Barium klorida terhidrasi (1:2:2); Barium klorida 2-hidrat; Barium klorida dihidrat; Barium diklorida, dihidrat; Barium(2+) klorida dihidrat |
| Di ChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
Massa molar BaCl2·2H2O
Massa molar barium klorida dihidrat (BaCl2·2H2O) adalah 244,26 g/mol. Nilai ini dapat dihitung dengan menjumlahkan massa atom setiap unsur yang ada dalam senyawa. Barium memiliki massa molar 137,33 g/mol, klor memiliki massa molar 35,45 g/mol, dan hidrogen dan oksigen memiliki massa molar masing-masing 1,01 g/mol dan 16,00 g/mol. Kedua molekul air menambahkan 36,02 g/mol lagi. Massa molar BaCl2·2H2O penting dalam perhitungan stoikiometri dimana jumlah reaktan atau produk dinyatakan dalam mol.
Formula Barium Klorida Dihidrat
Rumus kimia barium klorida dihidrat adalah BaCl2·2H2O. Rumus ini menunjukkan bahwa setiap satuan rumus senyawa mengandung satu ion barium, dua ion klorida, dan dua molekul air. Rumusnya penting untuk perhitungan stoikiometri dan untuk memahami sifat kimia dan fisik suatu senyawa.
Titik didih barium klorida dihidrat
BaCl2·2H2O memiliki titik didih 1560°C. Pada suhu tersebut senyawa akan mengalami peralihan fasa dari cair menjadi gas. Titik didih yang tinggi disebabkan oleh sifat ionik senyawa tersebut, yang memerlukan energi dalam jumlah besar untuk memecah gaya elektrostatik kuat yang mengikat ion-ion tersebut. BaCl2 · 2H2O digunakan dalam industri sebagai bahan pengolah panas pada permukaan logam karena titik leleh dan titik didihnya yang tinggi.
Titik leleh barium klorida dihidrat
Titik leleh BaCl2 · 2H2O adalah 962 °C. Pada suhu tersebut, senyawa akan berubah wujud dari padat menjadi cair. Tingginya titik leleh BaCl2·2H2O disebabkan oleh kuatnya ikatan ion antara ion barium dan klor, serta ikatan hidrogen antar molekul air. Titik leleh BaCl2·2H2O merupakan sifat penting untuk penggunaannya dalam berbagai aplikasi seperti produksi pigmen dan pewarna, serta perawatan permukaan logam.
Massa jenis barium klorida dihidrat g/ml
Massa jenis barium klorida dihidrat adalah 3,097 g/cm³. Artinya 1 cm³ barium klorida dihidrat memiliki berat 3,097 gram. Massa jenis suatu zat merupakan sifat penting yang dapat memberikan gambaran tentang sifat fisik dan kimianya. Dalam kasus barium klorida dihidrat, kepadatan yang tinggi disebabkan oleh massa atom barium yang relatif besar dan kepadatan ion dalam struktur kisi kristal.
BaCl2 · berat molekul 2H2O
Berat molekul BaCl2·2H2O adalah 244,26 g/mol. Nilai ini dapat dihitung dengan menjumlahkan berat atom setiap unsur yang ada dalam senyawa. Berat molekul merupakan sifat penting BaCl2 · 2H2O karena digunakan dalam berbagai aplikasi seperti produksi pigmen dan pewarna, dan sebagai reagen dalam percobaan laboratorium.
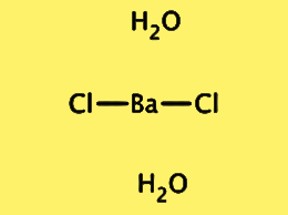
Struktur BaCl2·2H2O
Struktur kristal BaCl2·2H2O bersifat ortorombik, dengan grup ruang Pnma. Sel satuan berisi satu unit dengan rumus BaCl2·2H2O, terdiri dari satu ion barium, dua ion klorida, dan dua molekul air. Ion barium dikelilingi oleh delapan ion klorida dan molekul air terikat hidrogen pada ion klorida. Struktur kristal BaCl2 · 2H2O penting untuk memahami sifat fisik dan kimianya, serta penggunaannya dalam berbagai aplikasi.
| Penampilan | Padatan kristal putih |
| Berat jenis | 3,097 gram/cm³ |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 244,26 g/mol |
| Kepadatan | 3,097 gram/cm³ |
| Titik fusi | 962°C |
| Titik didih | 1560°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 31,2 g/100 mL (pada 20°C) |
| Kelarutan | Larut dalam alkohol dan aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Netral (7) |
Catatan: Tabel mungkin tidak disejajarkan dengan benar tergantung pada pengaturan tampilan platform atau perangkat yang Anda gunakan.
Keamanan dan bahaya barium klorida dihidrat
BaCl2 2H2O menimbulkan beberapa bahaya keselamatan dan kesehatan, yang dapat berbahaya jika tidak ditangani dengan benar. Ini adalah zat korosif yang dapat menyebabkan luka bakar parah pada kulit dan mata jika terkena. Menghirup debu atau uapnya dapat menyebabkan gangguan pernafasan dan kerusakan paru-paru. Ini juga beracun jika tertelan dan dapat menyebabkan masalah pencernaan. BaCl2 2H2O harus ditangani dengan hati-hati dan peralatan pelindung yang sesuai seperti sarung tangan, kacamata dan respirator harus dipakai saat bekerja dengan senyawa tersebut. Ini harus disimpan jauh dari bahan yang tidak kompatibel dan di tempat yang aman untuk mencegah paparan yang tidak disengaja. Dalam keadaan darurat, segera dapatkan bantuan medis.
| Simbol bahaya | Korosif (C) | |
| Deskripsi Keamanan | ||
| Sebuah pengidentifikasi | UN1564 | |
| kode HS | 28273990 | |
| Kelas bahaya | 8 | |
| Kelompok pengepakan | AKU AKU AKU | |
| Toksisitas | Beracun jika tertelan; dapat menyebabkan masalah pencernaan. Korosif terhadap kulit dan mata. Menghirup debu atau uap dapat menyebabkan masalah pernapasan dan kerusakan paru-paru. | |
Metode sintesis barium klorida dihidrat
Anda dapat mensintesis BaCl2 · 2H2O dengan beberapa metode.
Metode yang umum adalah mereaksikan barium karbonat atau barium hidroksida dengan asam klorida. Anda harus menguapkan larutan yang dihasilkan untuk mendapatkan senyawa padat.
Metode lain adalah dengan mereaksikan barium sulfida dengan asam klorida. Reaksi ini menghasilkan gas hidrogen sulfida, yang harus Anda buang dengan benar. Larutan yang diperoleh kemudian dimurnikan dengan cara filtrasi dan kristalisasi untuk memperoleh produk akhir.
Anda juga dapat mensintesis BaCl2 · 2H2O melalui reaksi pengendapan menggunakan natrium klorida dan barium nitrat. Anda perlu mencampurkan kedua senyawa tersebut dalam suatu larutan, kemudian menyaring dan mengeringkan endapan yang dihasilkan hingga diperoleh senyawa padat.
Selain itu, BaCl2 · 2H2O dapat disintesis melalui reaksi barium oksida dengan asam klorida. Reaksi ini menghasilkan air sebagai produk sampingan, yang harus Anda keluarkan melalui penguapan. Larutan yang diperoleh kemudian dikristalisasi untuk memperoleh produk akhir.
Saat bekerja dengan BaCl2 · 2H2O, Anda harus mengambil tindakan pencegahan keselamatan yang tepat karena merupakan senyawa korosif dan beracun. Anda harus mengenakan peralatan pelindung seperti sarung tangan, kacamata dan respirator, dan menangani senyawa tersebut di tempat yang berventilasi baik.
Kegunaan barium klorida dihidrat
BaCl2 2H2O memiliki beberapa kegunaan di berbagai industri.
- Industri kimia menggunakan BaCl2 · 2H2O sebagai reagen dalam beberapa reaksi kimia, seperti produksi garam barium, pigmen dan keramik.
- Ini berfungsi sebagai fluks dalam pemurnian logam dan sebagai katalis dalam sintesis organik.
- Industri medis menggunakan BaCl2 · 2H2O sebagai zat kontras dalam radiografi dan untuk mengobati keracunan barium. Itu juga digunakan dalam pembuatan semen gigi.
- Industri tekstil menggunakan BaCl2 2H2O sebagai mordan, zat pengikat pewarna pada serat, dan sebagai penghambat api pada tekstil.
- Dalam industri perminyakan, BaCl2 · 2H2O digunakan sebagai bahan tambahan pada lumpur pengeboran untuk meningkatkan kepadatan lumpur dan mencegah ledakan selama operasi pengeboran.
- Industri makanan menggunakan BaCl2 · 2H2O sebagai bahan pengawet dan penambah rasa pada makanan tertentu.
Tindakan pencegahan keselamatan yang tepat, seperti memakai peralatan pelindung dan menangani senyawa di area yang berventilasi baik, harus dilakukan untuk meminimalkan risiko yang terkait dengan bekerja dengan BaCl2 2H2O yang korosif dan beracun.
Pertanyaan:
Apa rumus barium klorida dihidrat?
Rumus barium klorida dihidrat adalah BaCl2·2H2O.
Apakah barium klorida dihidrat larut dalam air?
Ya, barium klorida dihidrat sangat larut dalam air. Ia mudah larut dalam air, dengan kelarutan sekitar 31,2 g/100 mL pada suhu kamar. Kelarutan yang tinggi ini menjadikannya senyawa yang berguna dalam berbagai industri, seperti dalam produksi garam barium dan sebagai aditif lumpur pengeboran pada industri perminyakan. Namun, kelarutannya yang tinggi juga dapat menimbulkan risiko bagi kesehatan manusia dan lingkungan jika tidak ditangani dengan benar, karena dapat mencemari sumber air dan menyebabkan keracunan pada organisme akuatik. Oleh karena itu, tindakan pencegahan yang tepat harus diambil ketika bekerja dengan BaCl2 2H2O untuk menghindari kontaminasi dan memastikan penanganan yang aman.
