Apa itu Amonium NH4+?
Ion amonium (NH4+) adalah ion poliatomik bermuatan positif yang terdiri dari satu atom nitrogen dan empat atom hidrogen. Hal ini umumnya ditemukan dalam pupuk dan senyawa organik.
| Nama IUPAC | Azanium |
| Formula molekul | NH4+ |
| nomor CAS | 14798-03-9 |
| Sinonim | Kation amonium, tetrahidridonitrogen (1+), aminonium, azanium, kation nitrogen hidrida, hidronitrogen, ion nitrogen |
| Di ChI | InChI=1S/H3N/h1H3/p+1 |
Catatan: InChI berkaitan dengan ion amonium dalam bentuk paling sederhana, dengan hidrogen terionisasi tunggal. InChI sebenarnya dapat bervariasi tergantung pada lingkungan kimia ion amonium.
rumus amonium
Rumus ion amonium adalah NH4+. Ini adalah kation poliatomik yang terdiri dari satu atom nitrogen dan empat atom hidrogen. Ion amonium dibentuk oleh protonasi amonia (NH3) dengan ion hidrogen (H+). Ion amonium adalah kation umum dalam senyawa anorganik dan organik, termasuk pupuk, obat-obatan, dan bahan peledak.
Kation amonium
Kation amonium, juga dikenal sebagai NH4+, adalah ion poliatomik bermuatan positif yang terdiri dari satu atom nitrogen dan empat atom hidrogen. Ini terbentuk ketika amonia (NH3) menerima proton (H+) dari asam, menghasilkan pembentukan garam amonium.
Massa molar ion amonium
Massa molar ion amonium (NH4+) adalah 18,04 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom nitrogen (14,01 g/mol) dan empat atom hidrogen (masing-masing 1,01 g/mol). Massa molar merupakan sifat penting dari ion amonium karena memungkinkan konversi massa menjadi mol dan sebaliknya. Hal ini berguna dalam banyak perhitungan kimia, seperti menentukan jumlah reaktan yang diperlukan untuk suatu reaksi kimia.
Titik didih ion amonium
Karena ion amonium biasanya ditemukan dalam garam, seperti amonium klorida (NH4Cl), ion amonium tidak mempunyai titik didih sendiri. Sebaliknya, titik didih amonium klorida, yaitu 520 °C, dipengaruhi oleh berbagai faktor seperti kekuatan ikatan ion antara ion amonium dan ion klorida, serta ukuran dan bentuk ion amonium.
Titik leleh ion amonium
Mirip dengan titik didih, ion amonium tidak memiliki titik leleh karena bukan merupakan zat yang ada dalam bentuk murni. Namun, garam yang mengandung ion amonium, seperti amonium nitrat (NH4NO3), memiliki titik leleh 169,6°C. Titik leleh amonium nitrat dipengaruhi oleh kekuatan ikatan ionik antara ion amonium dan ion nitrat, serta struktur kristal senyawanya.
Massa jenis ion amonium g/ml
Kepadatan ion amonium (NH4+) tidak berlaku karena merupakan ion poliatomik dan tidak ada sebagai entitas yang terpisah. Namun garam yang mengandung ion amonium, seperti amonium sulfat (NH4)2SO4, memiliki massa jenis 1,77 g/cm³ pada suhu kamar. Massa jenis garam yang mengandung ion amonium dipengaruhi oleh berbagai faktor, antara lain ukuran dan bentuk ion, kekuatan ikatan ion, dan struktur kristal senyawa.
Berat molekul ion amonium
Berat molekul ion amonium (NH4+) adalah 18,04 g/mol, dihitung dengan menjumlahkan massa atom satu atom nitrogen dan empat atom hidrogen. Berat molekul merupakan sifat penting ion amonium karena memungkinkan konversi massa menjadi mol dan sebaliknya. Hal ini berguna dalam banyak perhitungan kimia, seperti menentukan jumlah reaktan yang diperlukan untuk suatu reaksi kimia.
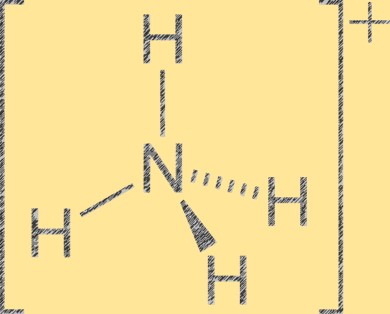
Struktur ion amonium
Ion amonium (NH4+) memiliki geometri molekul tetrahedral dengan satu atom nitrogen di tengah dan empat atom hidrogen di sudut tetrahedron. Atom nitrogen mempunyai muatan formal positif +1, sedangkan setiap atom hidrogen mempunyai muatan formal -1. Ion amonium adalah kation poliatomik yang dibentuk oleh protonasi amonia (NH3) dengan ion hidrogen (H+). Ion amonium adalah kation umum dalam senyawa anorganik dan organik, termasuk pupuk, obat-obatan, dan bahan peledak.
| Penampilan | Gas padat kristal berwarna putih atau tidak berwarna |
| Berat jenis | Tidak berlaku (ion poliatomik) |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 18,04 g/mol |
| Kepadatan | Tidak berlaku (ion poliatomik), kepadatan garam bervariasi (misalnya 1,77 g/cm³ untuk amonium sulfat) |
| Titik fusi | Tidak berlaku (ion poliatomik), titik leleh garam bervariasi (misalnya 169,6°C untuk amonium nitrat) |
| Titik didih | Tidak berlaku (ion poliatomik), titik didih garam bervariasi (misalnya 520 °C untuk amonium klorida) |
| Titik kilat | Tidak berlaku (ion poliatomik) |
| Kelarutan dalam air | Sangat larut (dapat larut sempurna) dalam air |
| Kelarutan | Larut dalam alkohol dan amonia cair |
| Tekanan uap | Tidak berlaku (ion poliatomik) |
| Kepadatan uap | Tidak berlaku (ion poliatomik) |
| pKa | 9.25 (asam terkonjugasi, kation amonium) |
| pH | 7 (netral) dalam larutan air |
Catatan: Nilai yang disajikan dalam tabel dapat bervariasi tergantung pada bentuk kimia dan kondisi spesifik ion amonium.
Keamanan dan bahaya ion amonium
Ion amonium, dalam bentuk murni, umumnya dianggap aman dan tidak beracun. Namun, seperti banyak senyawa kimia lainnya, ion amonium dapat menimbulkan bahaya dan risiko tertentu, terutama jika ditangani atau digunakan secara tidak tepat. Ion amonium dapat melepaskan gas amonia beracun ketika bereaksi dengan basa kuat atau asam kuat. Ini juga dapat menimbulkan bahaya kebakaran dan ledakan jika terkena panas atau nyala api. Selain itu, paparan ion amonium atau turunannya dalam konsentrasi tinggi dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan. Penting untuk mengikuti protokol keselamatan yang tepat dan menangani ion amonium dan turunannya dengan hati-hati untuk menghindari potensi bahaya.
| Simbol bahaya | Tidak ada yang ditetapkan untuk ion amonium murni |
| Deskripsi Keamanan | Berbahaya jika tertelan, terhirup atau terserap melalui kulit. Menyebabkan iritasi pada kulit, mata dan saluran pernapasan. Dapat melepaskan gas amonia beracun. Dapat menimbulkan bahaya kebakaran dan ledakan. |
| ID | 3077 (untuk senyawa amonium, termasuk garam amonium) |
| kode HS | 2827.10.00 (untuk amonium klorida, amonium karbonat dan garam amonium lainnya) |
| Kelas bahaya | 9 (Aneka bahan dan benda berbahaya) untuk senyawa amonium, Kelas 8 (Bahan korosif) untuk larutan amonium hidroksida |
| Kelompok pengepakan | III (untuk senyawa amonium) |
| Toksisitas | Umumnya dianggap tidak beracun dalam bentuk murni, namun dapat melepaskan gas amonia beracun. Senyawa amonium dan turunannya mungkin beracun atau berbahaya bagi kesehatan manusia dan lingkungan tergantung pada sifat dan penggunaan spesifiknya. |
Metode sintesis ion amonium
Ion amonium dapat disintesis menggunakan berbagai metode, termasuk reaksi kimia dan proses biologis.
Metode umum untuk mensintesis ion amonium adalah dengan mereaksikan gas amonia dengan asam, seperti asam klorida atau asam sulfat, untuk menghasilkan garam amonium. Reaksi ini melibatkan perpindahan ion hidrogen (H+) dalam asam oleh molekul amonia, menghasilkan pembentukan kation amonium (NH4+) dan anion asam yang sesuai (misalnya klorida, sulfat). Garam amonium yang dihasilkan dapat dimurnikan dan dikristalisasi untuk memperoleh ion amonium.
Proses biologis, seperti penguraian bahan organik oleh mikroba, juga dapat mengakibatkan pembentukan ion amonium. Selama proses ini, senyawa yang mengandung nitrogen dipecah oleh bakteri dan mikroorganisme lainnya, menghasilkan amonia dan akhirnya ion amonium. Proses ini dikenal sebagai amonifikasi dan merupakan langkah penting dalam siklus nitrogen.
Metode lain untuk mensintesis ion amonium adalah menggunakan proses Haber-Bosch, yang melibatkan reaksi gas nitrogen dan gas hidrogen dengan adanya katalis pada tekanan dan suhu tinggi. Gas amonia yang dihasilkan kemudian dapat bereaksi dengan asam menghasilkan ion amonium.
Kegunaan ion amonium
Ion amonium memiliki berbagai kegunaan dalam lingkungan industri, pertanian, dan laboratorium.
Ini melayani berbagai lingkungan industri, pertanian dan laboratorium, karena bertindak terutama sebagai pupuk di bidang pertanian, menyediakan nitrogen yang tersedia bagi tanaman sekaligus mengurangi pH tanah.
Industri kimia menggunakan ion amonium sebagai bahan utama dalam produksi berbagai senyawa, seperti pupuk, bahan peledak dan obat-obatan, serta dalam sintesis antibiotik dan obat-obatan lainnya. Ion amonium juga berfungsi sebagai bahan peledak dalam bentuk amonium nitrat.
Di laboratorium, peneliti menggunakan ion amonium sebagai reaktan dalam banyak reaksi kimia, seperti reaksi pengendapan dan sintesis organik, dan sebagai zat penyangga untuk menstabilkan pH larutan.
Selain itu, ion amonium digunakan dalam produk pembersih rumah tangga sebagai agen antimikroba karena kemampuannya membunuh bakteri dan jamur.
Banyaknya kegunaan ion amonium dan keserbagunaannya menjadikannya senyawa penting dalam berbagai industri dan aplikasi.
