Apa itu amonia?
Amonia atau NH3 adalah gas tidak berwarna dan berbau tajam yang terdiri dari nitrogen dan hidrogen, banyak digunakan dalam industri sebagai pendingin, bahan pembersih, dan pupuk.
| Nama IUPAC | Amonia |
| Formula molekul | NH3 |
| nomor CAS | 7664-41-7 |
| Sinonim | Azana, nitrogen trihidrida, alkohol Hartshorn |
| Di ChI | InChI=1S/NH3/c1-2 |
Sifat amonia
Struktur Lewis untuk amonia
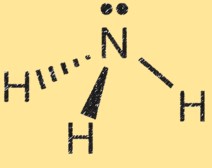
Struktur Lewis amonia (NH3) menunjukkan susunan elektron dalam molekul. Dalam struktur Lewis, titik melambangkan elektron dan garis melambangkan ikatan antar atom.
Struktur Lewis amonia menunjukkan atom nitrogen dikelilingi oleh tiga atom hidrogen dan sepasang elektron yang digunakan bersama antara atom nitrogen dan hidrogen. Ini mewakili ikatan kovalen dalam molekul. Atom nitrogen memiliki lima elektron valensi dan atom hidrogen masing-masing memiliki satu elektron valensi. Dalam struktur Lewis amonia, atom nitrogen membentuk tiga ikatan tunggal dengan atom hidrogen dan memiliki satu pasangan elektron yang tidak terbagi.
Rumus Amonia
Rumus kimia amonia adalah NH3. Rumusnya menunjukkan bahwa terdapat tiga atom hidrogen dan satu atom nitrogen dalam setiap molekul amonia. Rumusnya mewakili komposisi suatu zat dan memberikan informasi penting tentang sifat dan perilakunya.
Massa molar NH3
Massa molar suatu zat adalah massa satu mol zat dan dinyatakan dalam gram per mol. Massa molar amonia (NH3) adalah 17,0307 g/mol. Artinya satu mol amonia mempunyai massa 17,0307 gram. Massa molar suatu zat penting dalam menentukan jumlah mol dalam sampel tertentu dan dapat digunakan untuk menentukan rumus massa suatu senyawa.
Titik didih amonia
NH3 memiliki titik didih -33,34°C (-28,012°F). Titik didih suatu zat adalah suhu ketika tekanan uapnya sama dengan tekanan atmosfer dan zat tersebut mulai berubah dari cair menjadi gas. Titik didih NH3 relatif rendah dibandingkan bahan kimia lainnya, menjadikannya zat pendingin yang berguna dalam sistem pendingin dan pendingin.
NH3 Titik lebur
NH3 memiliki titik leleh -77,73°C (-107,87°F). Titik leleh suatu zat adalah suhu perubahan wujud padat menjadi cair. Titik leleh NH3 yang rendah menjadikannya zat pendingin yang berguna, karena dapat dengan mudah terkondensasi dari gas menjadi cair, sehingga memungkinkannya menyerap panas saat berubah wujud.
Kepadatan NH3 gram/ml
Massa jenis suatu zat adalah massa sampel per satuan volume. Massa jenis NH3 adalah 0,769 g/mL. Artinya satu mililiter NH3 mempunyai massa 0,769 gram. Massa jenis suatu zat dapat digunakan untuk menentukan jumlah materi yang ada dalam volume tertentu dan merupakan sifat penting untuk memahami bagaimana suatu zat berperilaku dalam berbagai keadaan.
Berat Molekul NH3
Berat molekul suatu zat adalah jumlah berat atom seluruh atom dalam satu molekul zat tersebut. Berat molekul NH3 (NH3) adalah 17,0307 g/mol. Artinya molekul NH3 mempunyai berat molekul 17,0307 gram per mol. Berat molekul suatu zat penting dalam menentukan jumlah mol dalam sampel tertentu dan dapat digunakan untuk menentukan rumus massa suatu senyawa.
struktur NH3
NH3 adalah molekul yang terdiri dari tiga atom hidrogen dan satu atom nitrogen. Atom nitrogen terikat dengan atom hidrogen melalui ikatan kovalen dan molekulnya berbentuk piramida trigonal. Sudut ikatan dalam molekul kira-kira 107°. NH3 merupakan molekul polar, artinya memiliki ujung positif dan negatif, dan umumnya digunakan sebagai pelarut dan reagen dalam reaksi kimia.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 0,59 (udara = 1) |
| Warna | Tanpa warna |
| Bau | Bau yang menyengat dan kuat |
| Masa molar | 17,0307 g/mol |
| Kepadatan | 0,769 gram/mL |
| Titik fusi | -77,73°C |
| Titik didih | -33,34°C |
| Titik kilat | Tidak berlaku (gas) |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air dan sebagian besar pelarut organik |
| Tekanan uap | 50,7 kPa pada 20°C |
| Kepadatan uap | 0,59 (udara = 1) |
| pKa | 4.75 |
| pH | 11.6 (larutan jenuh) |
Keamanan dan Bahaya Amonia
NH3 adalah gas yang sangat beracun dan korosif yang dapat membahayakan kesehatan manusia dan lingkungan jika tidak ditangani dengan benar. NH3 dapat menyebabkan luka bakar parah pada mata, kulit, dan saluran pernapasan, serta dapat berakibat fatal jika terhirup dalam konsentrasi tinggi. Selain itu, NH3 sangat reaktif dan dapat terbakar atau meledak jika terkena bahan kimia atau bahan tertentu.
Penting untuk mengambil tindakan pencegahan keselamatan saat menangani atau bekerja dengan NH3. Hal ini termasuk mengenakan pakaian pelindung, seperti sarung tangan, kacamata dan masker wajah, serta menyediakan ventilasi yang memadai untuk menghindari menghirup gas. Penting juga untuk menyimpan NH3 di tempat yang berventilasi baik, jauh dari sumber panas dan bahan mudah terbakar lainnya. Jika terkena NH3, penting untuk melepas pakaian yang terkontaminasi dan membilas area yang terkena dengan banyak air. Segera dapatkan bantuan medis jika gejala paparan muncul.
| Simbol bahaya | T+, N |
| Deskripsi Keamanan | Berbahaya bagi lingkungan, berbahaya jika terhirup, mengiritasi |
| Sebuah pengidentifikasi | PBB 1005 |
| kode HS | 2814.1 |
| Kelas bahaya | 2.3 |
| Kelompok pengepakan | II |
| Toksisitas | Dosis sangat beracun dan fatal (inhalasi) – 33-66 ppm |
Metode sintesis amonia
Ada beberapa metode untuk mensintesis amonia, antara lain proses Haber, proses Ostwald, dan proses Birkeland-Eyde.
Proses Haber, juga dikenal sebagai proses Haber-Bosch, adalah metode yang paling banyak digunakan untuk sintesis industri amonia. Dalam proses ini, gas nitrogen dari udara bereaksi dengan gas hidrogen melalui katalis besi membentuk amonia. Reaksi berlangsung pada tekanan tinggi (sekitar 150 atmosfer) dan suhu 450-500°C. Proses Haber sangat efisien, menghasilkan amonia dalam jumlah besar dengan hasil tinggi, dan digunakan sebagai sumber utama amonia untuk produksi pupuk dan bahan kimia lainnya.
Proses Ostwald, juga dikenal sebagai proses fiksasi nitrogen, adalah metode sintesis amonia yang lebih tua yang melibatkan oksidasi gas nitrogen menjadi oksida nitrat, diikuti oleh reaksi oksida nitrat dengan lebih banyak gas nitrogen untuk membentuk amonia. Proses ini kurang efisien dan sebagian besar telah digantikan oleh proses Haber.
Proses Birkeland-Eyde, juga dikenal sebagai proses plasma, adalah metode sintesis amonia terbaru yang menggunakan pelepasan plasma untuk memisahkan gas nitrogen dan hidrogen dan membentuk amonia. Proses ini masih dalam tahap pengembangan dan belum diadopsi secara luas untuk keperluan industri.
Singkatnya, proses Haber adalah metode yang paling umum digunakan untuk sintesis amonia, sedangkan proses Ostwald dan proses Birkeland-Eyde adalah metode yang lebih tua atau kurang banyak digunakan.
Kegunaan Amonia
Amonia adalah bahan kimia serbaguna yang memiliki berbagai kegunaan dalam industri dan pertanian. Beberapa kegunaan utama amonia meliputi:
- Produksi Pupuk: Bahan utama dalam produksi pupuk nitrogen, amonia meningkatkan hasil panen dan meningkatkan kesuburan tanah.
- Pendinginan: Sistem pendingin industri dan domestik menggunakan amonia sebagai zat pendingin, termasuk lemari es dan freezer.
- Pembersihan: Produk pembersih rumah tangga sering kali mengandung amonia karena kemampuannya melarutkan lemak dan kotoran.
- Farmasi: Produksi berbagai produk farmasi, seperti antasida dan sirup obat batuk, menggunakan amonia sebagai bahan bakunya.
- Produksi tekstil: Pencelupan dan pencetakan tekstil, serta produksi serat sintetis, menggunakan amonia.
- Pengolahan limbah: Pengolahan air limbah dan pengendalian bau dari instalasi pengolahan limbah melibatkan penggunaan amonia.
- Flame Retardants: Amonia bertindak sebagai penghambat api dalam produksi bahan seperti plastik, karet dan lain-lain.
- Produksi minyak dan gas: Industri minyak dan gas menggunakan amonia untuk memproduksi berbagai bahan kimia, termasuk surfaktan dan pengemulsi.
Kesimpulannya, amonia adalah bahan kimia serbaguna yang memiliki kegunaan luas di berbagai industri dan aplikasi, termasuk pertanian, pendinginan, pembersihan, farmasi, produksi tekstil, pengolahan limbah, penghambat api, serta produksi minyak dan gas.
Pertanyaan:
Apakah amonia termasuk asam atau basa?
Amonia dianggap basa. Dalam larutan air, ia larut membentuk ion hidroksida (OH-) dan bertindak sebagai basa lemah. Amonia memiliki pH basa (basa), biasanya sekitar 11. Larutan amonia dapat menetralkan asam untuk membentuk garam dan air, yang merupakan salah satu ciri khas basa. Dalam reaksi kimia, amonia juga dapat bertindak sebagai nukleofil dan berpartisipasi dalam reaksi yang membentuk Amida, yang merupakan turunan amonia dan mengandung karakteristik ikatan nitrogen-karbon amina dan Amida.
Apakah amonia bersifat polar?
Ya, amonia bersifat polar. Ia memiliki geometri molekul melengkung dengan atom nitrogen pusat dikelilingi oleh tiga atom hidrogen. Bentuk ini menciptakan momen dipol permanen, dengan ujung positif dipol terletak pada atom hidrogen dan ujung negatif terletak pada atom nitrogen. Sifat polar amonia memungkinkannya larut dalam pelarut polar seperti air, yang merupakan karakteristik molekul polar. Sifat polar amonia juga memungkinkannya untuk berpartisipasi dalam ikatan hidrogen, yang merupakan jenis gaya antarmolekul yang terjadi antar molekul polar. Ikatan hidrogen ini dapat menyebabkan titik didih dan titik leleh yang lebih tinggi dibandingkan molekul nonpolar dengan ukuran yang sama.
