Aluminium sulfat merupakan garam anorganik yang biasa digunakan sebagai zat koagulasi dalam proses pengolahan air dan sebagai zat flokulasi dalam pemurnian cairan.
| Nama IUPAC | Aluminium sulfat |
| Formula molekul | Al2(SO4)3 |
| nomor CAS | 10043-01-3 |
| Sinonim | Aluminium sulfat, diaaluminium sulfat, tawas kue, tawas pabrik kertas, tawas filter |
| Di ChI | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/jam;;(H2,1,2,3,4)/q2+3;/p-3 |
Rumus aluminium sulfat
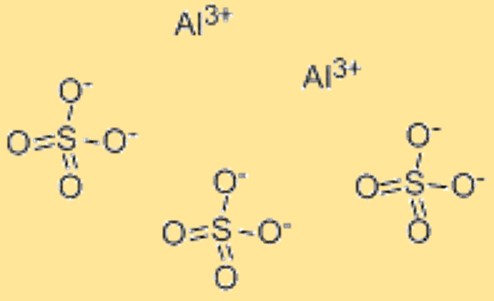
Rumus kimia aluminium sulfat adalah Al2(SO4)3. Rumus ini mewakili rasio atom dalam aluminium sulfat dan digunakan untuk menunjukkan komposisi senyawa. Rumusnya juga dapat digunakan dalam perhitungan kimia, seperti menentukan massa molar atau jumlah mol aluminium sulfat dalam sampel tertentu. Rumus kimia aluminium sulfat memberikan cara mudah untuk merepresentasikan komposisi bahan dan diakui secara luas dalam komunitas ilmiah. Selain itu, rumus tersebut dapat digunakan untuk memprediksi sifat kimia dan fisik aluminium sulfat, seperti kelarutannya dalam air, reaktivitasnya dengan senyawa lain, dan stabilitasnya dalam berbagai kondisi.
Massa Molar Aluminium Sulfat
Massa molar aluminium sulfat adalah 342,15 g/mol. Nilai ini penting dalam berbagai perhitungan kimia dan fisika, termasuk penentuan konsentrasi molar, stoikiometri reaksi, dan hukum gas ideal. Massa molar dihitung dengan menjumlahkan berat atom seluruh atom dalam rumus kimia aluminium sulfat, yaitu Al2(SO4)3. Massa molar juga dapat digunakan untuk mengubah massa menjadi jumlah mol untuk sampel aluminium sulfat tertentu.
Titik didih aluminium sulfat
Titik didih aluminium sulfat tidak dapat ditentukan dengan jelas karena terurai sebelum dididihkan. Aluminium sulfat adalah garam terhidrasi dan ketika dipanaskan ia kehilangan air hidrasinya dan terurai menjadi aluminium oksida dan asam sulfat. Suhu penguraian dapat bervariasi dari 120°C hingga 140°C, tergantung pada derajat hidrasi. Adanya pengotor dalam sampel juga dapat mempengaruhi suhu dekomposisi.
Titik leleh aluminium sulfat
Titik leleh aluminium sulfat kira-kira 1200°C. Suhu tinggi ini disebabkan oleh kuatnya ikatan ion antara aluminium dan ion belerang. Aluminium sulfat adalah padatan kristal pada suhu kamar dan memiliki struktur kristal yang jelas, sehingga berkontribusi terhadap titik lelehnya yang tinggi. Titik leleh aluminium sulfat penting dalam menentukan kondisi pemrosesan yang diperlukan untuk sintesis dan pemurnian bahan.
Massa jenis aluminium sulfat g/ml
Kepadatan aluminium sulfat adalah 1,8 hingga 2,0 g/mL. Nilai ini dapat bervariasi tergantung pada derajat hidrasi dan adanya pengotor dalam sampel. Massa jenis aluminium sulfat merupakan sifat fisik penting yang dapat digunakan untuk menghitung volume suatu massa suatu bahan. Massa jenis aluminium sulfat juga berguna dalam menentukan konsentrasi suatu larutan, karena memungkinkan seseorang menghitung massa zat terlarut per satuan volume pelarut.
Berat Molekul Aluminium sulfat
Kita menentukan bahwa berat molekul aluminium sulfat adalah 342,15 g/mol dengan menambahkan berat atom semua atom dalam rumus kimianya Al2(SO4)3. Nilai ini berfungsi sebagai berat molekul dan massa molar dan memainkan peran penting dalam perhitungan kimia, termasuk menentukan konsentrasi molar dan stoikiometri reaksi.
Struktur aluminium sulfat
Aluminium sulfat memiliki struktur kristal yang tersusun dari kation aluminium (Al3+) dan anion sulfat (SO4^2-). Kation aluminium berkoordinasi dengan enam anion sulfat dalam susunan heksagonal yang rapat, disatukan oleh ikatan ionik yang kuat. Struktur kristal aluminium sulfat mempengaruhi sifat fisiknya, seperti titik leleh dan kelarutannya.
| Penampilan | Kristal padat |
| Berat jenis | 1,8 hingga 2,0 g/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 342,15 g/mol |
| Kepadatan | 1,8 hingga 2,0 g/ml |
| Titik fusi | 770°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut dalam air |
| Kelarutan | Larut dalam air |
| Tekanan uap | Tidak terdefinisi dengan baik |
| Kepadatan uap | Tidak terdefinisi dengan baik |
| pKa | Tidak terdefinisi dengan baik |
| pH | Netral |
Keamanan dan bahaya aluminium sulfat
Aluminium sulfat adalah zat berbahaya yang harus ditangani dengan hati-hati. Menghirup debunya dapat menyebabkan iritasi saluran pernapasan dan batuk. Kontak dengan kulit atau mata dapat menyebabkan kemerahan, gatal dan sensasi terbakar. Menelan aluminium sulfat dapat menyebabkan iritasi gastrointestinal, termasuk mual, muntah, dan diare. Jika tertelan dalam jumlah banyak, dapat menyebabkan masalah kesehatan yang lebih serius, seperti depresi sistem saraf pusat dan kerusakan ginjal. Oleh karena itu, penting untuk memakai alat pelindung diri, seperti sarung tangan dan kacamata, saat menangani aluminium sulfat. Selain itu, area kerja harus memiliki ventilasi yang baik untuk mengurangi risiko terhirupnya debu. Jika terjadi kontak dengan kulit atau mata, area yang terkena harus dibilas dengan banyak air setidaknya selama 15 menit dan perhatian medis harus segera dicari.
| Simbol bahaya | Xi – Menjengkelkan |
| Deskripsi Keamanan | S24/25 – Hindari kontak dengan kulit dan mata |
| Sebuah pengidentifikasi | UN3077 – Bahaya lingkungan |
| kode HS | 2833.30.00 |
| Kelas bahaya | 8 – Zat korosif |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah hingga sedang jika tertelan, terhirup, atau terkena kulit atau mata |
Metode sintesis aluminium sulfat
Aluminium sulfat dapat disintesis dengan berbagai metode, termasuk pengendapan dan reaksi dengan asam sulfat.
Salah satu metode sintesisnya adalah metode pengendapan, yang melibatkan pencampuran larutan garam aluminium dengan asam sulfat. Reaksi ini menghasilkan pembentukan aluminium sulfat, yang mengendap dari larutan dalam bentuk padat. Padatan tersebut kemudian dapat disaring, dicuci dan dikeringkan untuk mendapatkan aluminium sulfat murni.
Metode sintesis lainnya adalah metode reaksi, yang melibatkan pencampuran aluminium hidroksida atau aluminium oksida dengan asam sulfat. Reaksi ini menghasilkan pembentukan aluminium sulfat dan air. Produk kemudian dapat dimurnikan dengan mencuci dan mengeringkan.
Dalam kedua metode tersebut, kemurnian produk akhir dapat ditingkatkan dengan menggunakan bahan awal dengan kemurnian tinggi dan mengontrol kondisi reaksi secara hati-hati. Kemurnian aluminium sulfat dapat diperiksa dengan menganalisis sifat fisik dan kimianya, seperti massa molar, titik leleh, dan kelarutan dalam air.
Secara keseluruhan, sintesis aluminium sulfat adalah proses yang relatif sederhana yang dapat dilakukan di laboratorium atau di lingkungan industri, bergantung pada skala produksi yang diinginkan. Pemilihan metode sintesis akan bergantung pada ketersediaan bahan baku, kemurnian produk yang diinginkan, dan skala produksi yang diinginkan.
Kegunaan Aluminium Sulfat
Industri menggunakan aluminium sulfat karena keserbagunaannya dalam berbagai aplikasi seperti pengolahan air, produksi kertas, dan pertanian. Dalam pengolahan air, zat tersebut bertindak sebagai koagulan dan memurnikan air minum dengan menyebabkan kotoran berkumpul dan membentuk partikel yang lebih besar sehingga mudah disaring. Industri produksi kertas menggunakan aluminium sulfat sebagai bahan pengisi dan pengikat untuk meningkatkan kekuatan dan kilap kertas serta mengatur tingkat pH dalam pulp. Di bidang pertanian, aluminium sulfat menurunkan pH tanah dan meningkatkan keasaman, menyediakan nutrisi penting bagi tanaman seperti belerang dan aluminium. Aluminium sulfat juga memiliki kegunaan lain, termasuk penyamakan kulit, tekstil tahan api, dan sebagai flokulan dalam pengolahan air limbah. Oleh karena itu, aluminium sulfat berperan penting dalam kehidupan modern dengan melayani beberapa keperluan di berbagai industri.
Pertanyaan:
Apa rumus aluminium sulfat?
Rumus kimia aluminium sulfat adalah Al2(SO4)3.
Apakah aluminium sulfat larut?
Ya, aluminium sulfat larut dalam air. Ini larut dalam air untuk membentuk larutan ion aluminium, sulfat dan hidroksida. Kelarutan aluminium sulfat dalam air bergantung pada suhu, artinya aluminium sulfat lebih mudah larut pada suhu tinggi dan kurang larut pada suhu rendah. Pada suhu kamar, aluminium sulfat mudah larut dalam air, dengan kelarutan kurang lebih 20 gram per 100 mililiter air.
