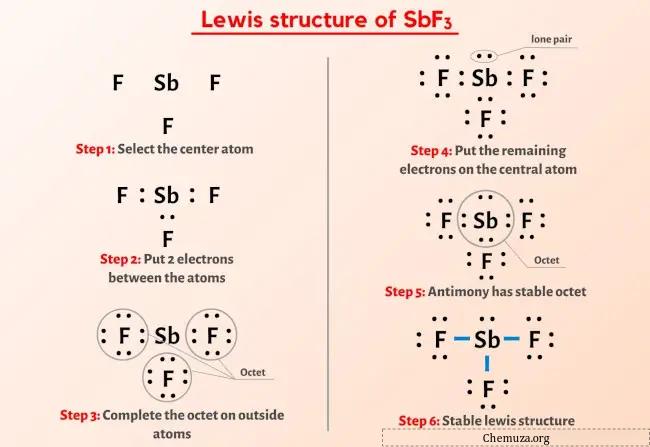
Jadi Anda sudah melihat gambar di atas kan?
Izinkan saya menjelaskan secara singkat gambar di atas.
Struktur Lewis SbF3 memiliki atom antimon (Sb) di tengahnya yang dikelilingi oleh tiga atom fluor (F). Terdapat 3 ikatan tunggal antara atom Antimon (Sb) dan masing-masing atom Fluor (F). Terdapat 1 pasangan elektron bebas pada atom antimon (Sb) dan 3 pasangan elektron bebas pada tiga atom fluor (F).
Jika Anda tidak memahami apa pun dari gambar struktur Lewis SbF3 di atas, tetaplah bersama saya dan Anda akan mendapatkan penjelasan langkah demi langkah yang mendetail tentang cara menggambar struktur Lewis SbF3 .
Jadi mari kita lanjutkan ke langkah-langkah menggambar struktur Lewis SbF3.
Langkah-langkah menggambar struktur Lewis SbF3
Langkah 1: Temukan jumlah total elektron valensi dalam molekul SbF3
Untuk mengetahui jumlah total elektron valensi dalam molekul SbF3 , pertama-tama Anda perlu mengetahui elektron valensi yang ada dalam atom antimon serta atom fluor.
(Elektron valensi adalah elektron yang ada di orbit terluar atom mana pun.)
Di sini saya akan memberi tahu Anda cara mudah menemukan elektron valensi antimon dan fluor menggunakan tabel periodik.
Total elektron valensi dalam molekul SbF3
→ Elektron valensi diberikan oleh atom antimon:
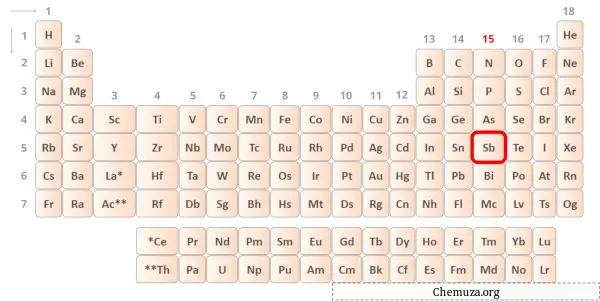
Antimon adalah unsur dalam golongan 15 tabel periodik. [1] Oleh karena itu, elektron valensi yang ada dalam antimon adalah 5 .
Anda dapat melihat 5 elektron valensi yang terdapat pada atom antimon, seperti terlihat pada gambar di atas.
→ Elektron valensi diberikan oleh atom fluor:
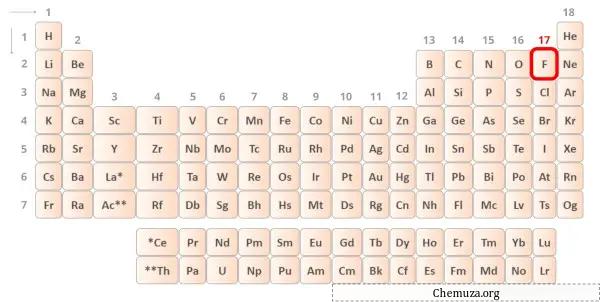
Fluorit adalah unsur dalam golongan 17 tabel periodik. [2] Oleh karena itu, elektron valensi yang ada dalam fluorit adalah 7 .
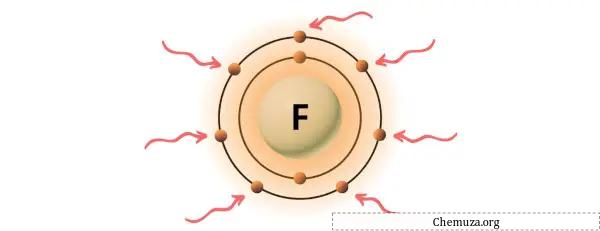
Anda dapat melihat 7 elektron valensi yang terdapat pada atom fluor seperti terlihat pada gambar di atas.
Jadi,
Jumlah elektron valensi dalam molekul SbF3 = elektron valensi yang disumbangkan oleh 1 atom antimon + elektron valensi yang disumbangkan oleh 3 atom fluor = 5 + 7(3) = 26 .
Langkah 2: Pilih atom pusat
Untuk memilih atom pusat, kita harus ingat bahwa atom yang paling elektronegatifnya tetap berada di pusat.
Sekarang molekul yang diberikan adalah SbF3 dan mengandung atom antimon (Sb) dan atom fluor (F).
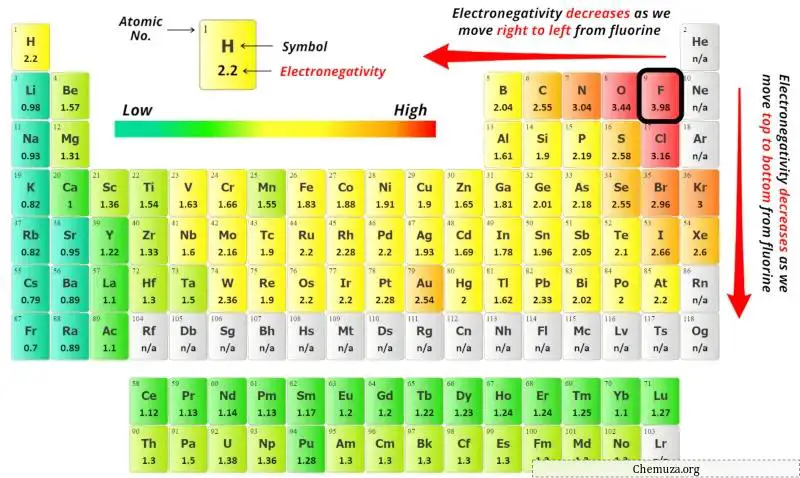
Nilai keelektronegatifan atom antimon (Sb) dan atom fluor (F) dapat Anda lihat pada tabel periodik di atas.
Jika kita membandingkan nilai keelektronegatifan antimon (Sb) dan fluor (F), maka atom antimon tersebut kurang elektronegatif .
Di sini, atom antimon (Sb) adalah atom pusat dan atom fluor (F) adalah atom terluar.
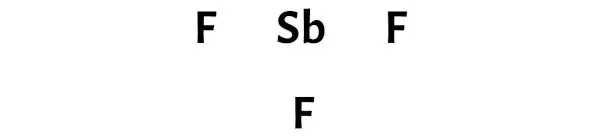
Langkah 3: Hubungkan setiap atom dengan menempatkan sepasang elektron di antara keduanya
Sekarang dalam molekul SbF3, kita harus menempatkan pasangan elektron antara atom antimon (Sb) dan atom fluor (F).
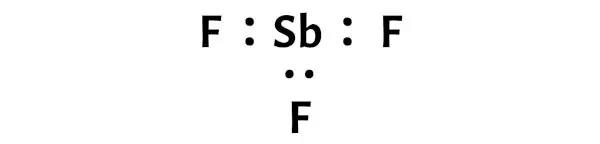
Hal ini menunjukkan bahwa antimon (Sb) dan fluor (F) terikat secara kimia satu sama lain dalam molekul SbF3.
Langkah 4: Jadikan atom luar stabil. Tempatkan sisa pasangan elektron valensi pada atom pusat.
Pada langkah ini Anda perlu memeriksa stabilitas atom luar.
Di sini, pada sketsa molekul SbF3 Anda dapat melihat bahwa atom terluar adalah atom fluor.
Atom fluor eksternal ini membentuk oktet dan karenanya stabil.
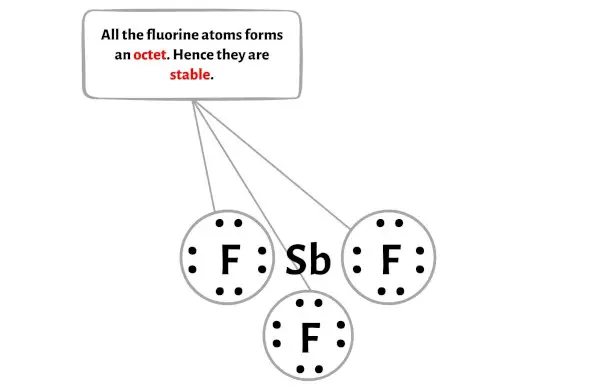
Selain itu, pada langkah 1, kami menghitung jumlah elektron valensi yang ada dalam molekul SbF3.
Molekul SbF3 memiliki total 26 elektron valensi dan dari jumlah tersebut, hanya 24 elektron valensi yang digunakan pada diagram di atas.
Jadi jumlah elektron yang tersisa = 26 – 24 = 2 .
Anda perlu menempatkan 2 elektron ini pada atom antimon pusat pada diagram molekul SbF3 di atas.
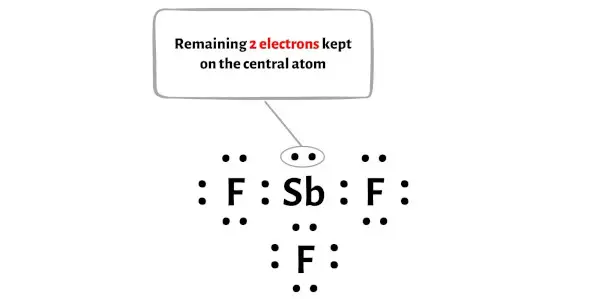
Sekarang mari kita lanjutkan ke langkah berikutnya.
Langkah 5: Periksa oktet pada atom pusat
Pada langkah ini, Anda perlu memeriksa apakah atom pusat antimon (Sb) stabil atau tidak.
Untuk mengetahui kestabilan atom antimon pusat (Sb), perlu dilakukan pengecekan apakah membentuk oktet atau tidak.
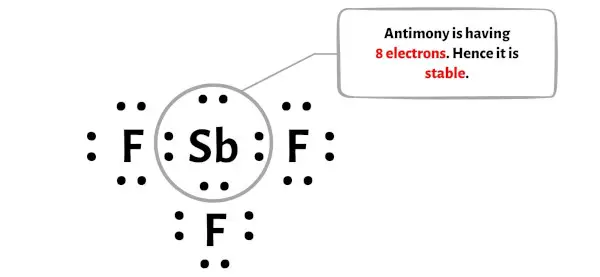
Anda dapat melihat pada gambar di atas bahwa atom antimon membentuk oktet. Artinya ia mempunyai 8 elektron.
Jadi atom antimon pusatnya stabil.
Sekarang mari kita lanjutkan ke langkah terakhir untuk memeriksa apakah struktur Lewis SbF3 stabil atau tidak.
Langkah 6: Periksa stabilitas struktur Lewis
Sekarang Anda telah sampai pada langkah terakhir di mana Anda perlu memeriksa stabilitas struktur Lewis SbF3.
Stabilitas struktur Lewis dapat diverifikasi dengan menggunakan konsep muatan formal .
Singkatnya, sekarang kita harus menemukan muatan formal pada atom antimon (Sb) serta atom fluor (F) yang ada dalam molekul SbF3.
Untuk menghitung pajak formal, Anda harus menggunakan rumus berikut:
Muatan formal = Elektron valensi – (Elektron ikatan)/2 – Elektron non-ikatan
Jumlah elektron ikatan dan elektron non-ikatan setiap atom molekul SbF3 dapat Anda lihat pada gambar di bawah ini.
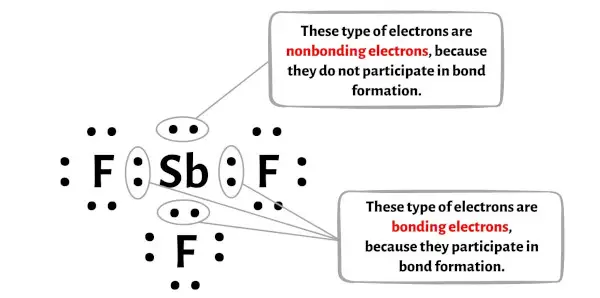
Untuk atom antimon (Sb):
Elektron valensi = 5 (karena antimon berada pada golongan 15)
Elektron ikatan = 6
Elektron tidak terikat = 2
Untuk atom fluor (F):
Elektron valensi = 7 (karena fluorit berada pada golongan 17)
Elektron ikatan = 2
Elektron tidak terikat = 6
| Tuduhan formal | = | elektron valensi | – | (Mengikat elektron)/2 | – | Elektron yang tidak terikat | ||
| Sb | = | 5 | – | 6/2 | – | 2 | = | 0 |
| F | = | 7 | – | 2/2 | – | 6 | = | 0 |
Dari perhitungan muatan formal di atas, terlihat bahwa atom antimon (Sb) dan atom fluor (F) mempunyai muatan formal “nol” .
Hal ini menunjukkan bahwa struktur Lewis SbF3 di atas stabil dan tidak ada perubahan lebih lanjut pada struktur SbF3 di atas.
Dalam struktur titik Lewis SbF3 di atas, Anda juga dapat menyatakan setiap pasangan elektron ikatan (:) sebagai ikatan tunggal (|). Melakukan hal itu akan menghasilkan struktur Lewis SbF3 berikut.
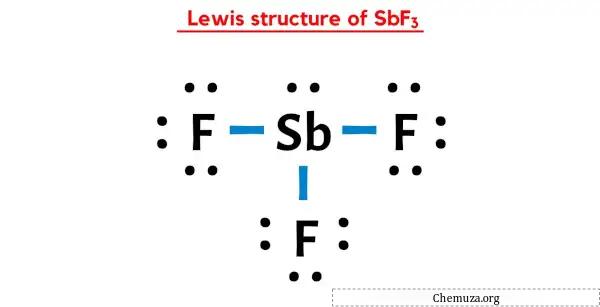
Saya harap Anda telah memahami sepenuhnya semua langkah di atas.
Untuk lebih banyak latihan dan pemahaman yang lebih baik, Anda dapat mencoba struktur Lewis lainnya yang tercantum di bawah.
Cobalah (atau setidaknya lihat) struktur Lewis ini untuk pemahaman yang lebih baik:
