Nikel fluorida (NiF2) adalah senyawa kimia. Ini terdiri dari atom nikel dan fluor. Digunakan dalam berbagai aplikasi termasuk baterai dan pelapisan listrik karena sifatnya yang unik.
| Nama IUPAC | Nikel(II) fluorida |
| Formula molekul | NiF2 |
| nomor CAS | 10028-18-9 |
| Sinonim | Nikel difluorida, nikel fluorida, difluoronikel |
| Di ChI | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
Sifat nikel fluorida
Formula Nikel Fluorida
Rumus kimia nikel difluorida adalah NiF2. Artinya setiap molekul nikel difluorida terdiri dari satu atom nikel dan dua atom fluor yang terikat bersama.
Massa Molar Nikel Fluorida
Nikel difluorida memiliki massa molar sekitar 96,69 gram per mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom nikel (58,69 g/mol) dan dua atom fluor (masing-masing 18,998 g/mol).
Titik didih nikel fluorida
Titik didih nikel difluorida relatif tinggi, sekitar 1.568 derajat Celsius (2.854 derajat Fahrenheit). Suhu ini mewakili titik di mana nikel difluorida berubah dari fase cair menjadi gas.
Titik lebur nikel fluorida
Nikel difluorida memiliki titik leleh sekitar 1.372 derajat Celsius (2.502 derajat Fahrenheit). Ini adalah suhu di mana nikel difluorida padat berubah menjadi cair.
Massa jenis nikel fluorida g/mL
Massa jenis nikel difluorida kira-kira 4,72 gram per sentimeter kubik (g/cm³). Nilai massa jenis ini memberikan gambaran mengenai massa jenis partikel dalam suatu volume zat tertentu.
Berat Molekul Nikel Fluorida
Berat molekul nikel difluorida kira-kira 96,69 gram per mol. Hal ini ditentukan dengan menambahkan berat atom unsur-unsur penyusunnya dalam rumus kimia NiF2.
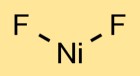
Struktur nikel fluorida
Nikel difluorida memiliki struktur kristal. Atom nikel berada di tengah, terikat pada dua atom fluor. Susunan atom menimbulkan pola berulang, membentuk kisi kristal.
Kelarutan nikel fluorida
Nikel difluorida sulit larut dalam air. Kelarutannya dipengaruhi oleh faktor-faktor seperti suhu dan keberadaan zat lain. Ketika larut, ia berdisosiasi menjadi ion Ni+2 dan F- dalam larutan air.
| Penampilan | Padatan kristal berwarna hijau |
| Berat jenis | 4,72 gram/cm³ |
| Warna | Hijau |
| Bau | Tidak berbau |
| Masa molar | 96,69 g/mol |
| Kepadatan | 4,72 gram/cm³ |
| Titik fusi | 1372°C (2502°F) |
| Titik didih | 1.568°C (2.854°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Larut dalam air, terdisosiasi menjadi ion nikel dan ion fluorida |
| Tekanan uap | Tidak terdefinisi dengan baik |
| Kepadatan uap | Tidak terdefinisi dengan baik |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Nikel Fluorida
Nikel difluorida mempunyai potensi risiko keamanan. Ini dapat menyebabkan iritasi kulit dan mata jika terkena. Menghirup debu atau asapnya dapat menyebabkan iritasi pernafasan. Paparan yang terlalu lama dapat menyebabkan dampak kesehatan yang lebih serius. Tindakan perlindungan yang tepat, termasuk sarung tangan dan kacamata pengaman, harus digunakan saat menangani nikel difluorida. Ruang kerja harus memiliki ventilasi yang baik untuk meminimalkan risiko terhirup. Jika tertelan atau kontak tidak disengaja, perhatian medis diperlukan. Potensi dampak nikel difluorida terhadap lingkungan juga harus dipertimbangkan, dan pembuangannya harus mengikuti peraturan yang sesuai untuk menghindari kontaminasi.
| Simbol bahaya | Bahaya kesehatan |
| Deskripsi Keamanan | Menyebabkan iritasi kulit dan mata. Berbahaya jika terhirup atau tertelan. Paparan yang terlalu lama dapat menyebabkan efek kesehatan yang lebih serius. Tangani dengan peralatan pelindung yang sesuai. Hindari penghirupan dan kontak. |
| Nomor identifikasi PBB | Tidak diatribusikan |
| kode HS | 2826.20.1000 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Cukup beracun |
Metode sintesis nikel fluorida
Nikel difluorida dapat disintesis dengan berbagai metode. Pendekatan umum melibatkan reaksi antara nikel oksida (NiO) atau nikel karbonat (NiCO3) dengan asam fluorida (HF):
- Reaksi dengan asam fluorida :
- Metode nikel oksida (NiO): NiO + 2 HF → NiF2 + H2O
- Nikel Karbonat (NiCO3) Metode: NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
Metode lain menggunakan reaksi antara nikel klorida (NiCl2) dan amonium fluorida (NH4F):
- Reaksi dengan amonium fluorida : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
Selain itu, nikel difluorida dapat diperoleh melalui reaksi nikel oksida dengan amonium fluorida:
- Reaksi dengan amonium fluorida (metode nikel oksida) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
Metode ini umumnya dilakukan pada suhu dan kondisi yang terkendali untuk memastikan sintesis dan kemurnian produk yang tepat. Penting untuk menangani asam fluorida dan reagen lainnya dengan hati-hati karena potensi bahayanya. Nikel difluorida yang dihasilkan dapat dimurnikan dan diproses untuk berbagai aplikasi, seperti bahan baterai dan pelapisan listrik.
Kegunaan Nikel Fluorida
Nikel difluorida (NiF2) menemukan berbagai aplikasi karena sifatnya yang unik. Ini melayani di berbagai industri untuk tujuan berbeda:
- Teknologi baterai: digunakan sebagai komponen dalam baterai lithium-ion, meningkatkan kinerja dan stabilitasnya.
- Elektroplating: Digunakan dalam proses pelapisan listrik untuk menciptakan lapisan nikel yang tahan lama dan tahan korosi pada berbagai bahan.
- Katalisis: Bertindak sebagai katalis dalam reaksi kimia tertentu, membantu sintesis produk berharga.
- Kaca dan keramik: Digabungkan dalam produksi kaca dan keramik khusus, meningkatkan sifat dan karakteristiknya.
- Fluoridasi: Digunakan untuk fluoridasi air untuk meningkatkan kesehatan gigi dengan mencegah kerusakan gigi.
- Manufaktur Bahan Kimia: Berfungsi sebagai prekursor dalam sintesis senyawa nikel dan bahan kimia lainnya.
- Kapasitor keramik: hadir dalam pembuatan kapasitor keramik yang digunakan dalam bidang elektronik dan telekomunikasi.
- Farmasi: digunakan sebagai reagen dalam proses dan penelitian farmasi tertentu.
- Fotografi: Secara historis digunakan dalam industri fotografi sebagai komponen pengembang fotografi tertentu.
- Aditif Paduan Logam: Ditambahkan ke paduan logam tertentu untuk meningkatkan sifat-sifatnya seperti kekuatan dan ketangguhan.
Karakteristik nikel difluorida yang mudah beradaptasi menjadikannya sumber daya berharga di berbagai industri, berkontribusi terhadap kemajuan teknologi, perawatan kesehatan, dan manufaktur.
Pertanyaan:
Q: Apa produk pada dua elektroda selama elektrolisis larutan NiF2(aq)?
A: Di katoda terbentuk logam nikel (Ni), sedangkan di anoda terbentuk gas fluor (F2).
T: Apa yang dihasilkan elektrolisis NiF2?
J: Nikel logam diproduksi di katoda dan gas fluor dihasilkan di anoda selama elektrolisis NiF2.
Q: Senyawa NiF2 merupakan senyawa ionik. Ion apa yang menyusunnya?
A: NiF2 terdiri dari ion nikel (Ni²⁺) dan ion F-.
Q: Jenis reaksi apakah Ni(s) + F2 —> NiF2(s)?
A: Reaksi Ni(s) + F2 → NiF2(s) merupakan reaksi kombinasi (sintesis).
Q: Apa nama senyawa yang rumusnya NiF2?
A: Senyawa dengan rumus NiF2 disebut nikel(II) difluorida.
T: Di mana nikel(II) fluorida digunakan?
J: Nikel(II) difluorida digunakan dalam teknologi baterai, pelapisan listrik, katalis, dan manufaktur keramik.
T: Apa rumus nikel(II) fluorida?
J: Rumus nikel(II) difluorida adalah NiF2.
T: Apakah nikel(II) fluorida dan natrium hidroksida mengendap?
J: Ya, endapannya berbentuk padatan hijau, nikel(II) hidroksida.
T: Apakah nikel fluorida dapat menghantarkan listrik?
A: Ya, nikel difluorida dapat menghantarkan listrik dalam keadaan cair atau bila dilarutkan dalam air.
T: Apakah lelehan nikel fluorida atau grafit lebih konduktif?
J: Nikel difluorida cair lebih konduktif dibandingkan grafit karena sifat ionik dan ion bergeraknya.
