Seng sulfida (ZnS) merupakan senyawa yang tersusun dari seng dan belerang. Ini digunakan dalam berbagai aplikasi termasuk bahan luminescent, optoelektronik, dan fosfor untuk tampilan LED.
| Nama IUPAC | Seng sulfida |
| Formula molekul | ZnS |
| nomor CAS | 1314-98-3 |
| Sinonim | Sphalerit, Blende, Seng Blende, Wurtzite |
| Di ChI | InChI=1S/S.Zn |
Sifat seng sulfida
Formula Seng Sulfida
Rumus kimia seng sulfida adalah ZnS, yang menunjukkan komposisi atom seng (Zn) dan belerang (S). Senyawa ini merupakan bagian penting dari berbagai aplikasi industri dan ilmiah karena sifatnya yang unik.
Massa Molar Seng Sulfida
Seng sulfida memiliki massa molar sekitar 97,45 gram per mol. Nilai ini mewakili gabungan massa atom penyusun atom seng dan belerang dalam satu molekul ZnS.
Titik didih seng sulfida
Seng sulfida tidak memiliki titik didih yang jelas karena cenderung terurai daripada mengalami proses perebusan yang sebenarnya saat dipanaskan. Karakteristik ini disebabkan oleh sifat kimianya.
Titik Leleh Seng Sulfida
Seng sulfida memiliki titik leleh sekitar 1.850 derajat Celsius (3.362 derajat Fahrenheit). Titik leleh yang tinggi ini membuatnya cocok untuk berbagai aplikasi suhu tinggi.
Massa jenis seng sulfida g/mL
Kepadatan seng sulfida bervariasi tergantung pada bentuk kristalnya. Umumnya massa jenisnya antara 3,98 dan 4,09 gram per sentimeter kubik (g/cm³). Kisaran kepadatan ini berkontribusi terhadap penggunaannya dalam bahan optik.
Berat Molekul Seng Sulfida
Berat molekul seng sulfida, dihitung dengan menjumlahkan massa atom komponennya, adalah sekitar 97,45 gram per mol. Nilai ini sangat penting untuk menentukan jumlah ZnS dalam sampel tertentu.
Struktur seng sulfida
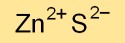
Seng sulfida terdapat dalam struktur kristal yang berbeda, terutama sebagai campuran seng kubik (juga dikenal sebagai sfalerit) dan wurtzit heksagonal. Susunan atom ini menentukan sifat fisik dan optiknya.
Kelarutan seng sulfida
Seng sulfida sulit larut dalam air, sehingga hampir tidak larut. Karakteristik ini disebabkan oleh ikatan yang kuat antara atom seng dan belerang, sehingga menyebabkan kelarutan yang terbatas dalam larutan air. Namun, ia dapat dilarutkan dalam asam atau basa tertentu dalam kondisi tertentu.
| Penampilan | Padat |
| Berat jenis | 3,98 – 4,09 gram/cm³ |
| Warna | Putih, kuning, coklat, hitam |
| Bau | Tidak berbau |
| Masa molar | ~97,45 g/mol |
| Kepadatan | 3,98 – 4,09 gram/cm³ |
| Titik fusi | ~1850°C (~3362°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Hampir tidak larut |
| Kelarutan | Larut dalam asam, basa dalam kondisi tertentu |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | ~4.7 |
| pH | ~7 (netral) |
Keamanan dan Bahaya Seng Sulfida
Seng sulfida memiliki toksisitas akut yang rendah tetapi dapat melepaskan sulfur dioksida beracun saat dipanaskan. Umumnya dianggap aman dalam kondisi penanganan normal. Namun, menghirup debu atau uapnya dapat menyebabkan iritasi pernafasan. Hindari kontak dengan kulit dan mata. Jika terkena, bilas hingga bersih dan konsultasikan dengan dokter jika iritasi masih berlanjut. Kebakaran atau panas berlebih dapat menyebabkan penguraian dan melepaskan gas berbahaya. Simpan jauh dari bahan yang tidak kompatibel. Tangani dengan hati-hati, kenakan peralatan pelindung yang sesuai, dan bekerja di area yang berventilasi baik untuk memastikan keselamatan dan mencegah potensi bahaya yang terkait dengan seng sulfida.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Toksisitas akut rendah; melepaskan gas sulfur dioksida beracun saat dipanaskan; tangani dengan hati-hati |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2830.90.10 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah; iritasi pernapasan akibat debu atau asap; tangani dengan hati-hati |
Metode sintesis seng sulfida
Seng sulfida dapat disintesis dengan berbagai metode. Pendekatan yang umum adalah dengan mereaksikan gas seng oksida (ZnO) dan hidrogen sulfida (H2S) pada suhu tinggi. Reaksi berlangsung sebagai berikut:
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Metode lain melibatkan reaksi antara seng klorida (ZnCl2) dan gas hidrogen sulfida:
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
Alternatifnya, nanopartikel seng sulfida dapat disintesis menggunakan metode presipitasi. Hal ini melibatkan pencampuran garam seng terlarut dengan garam sulfida terlarut dalam kondisi terkendali, yang mengarah pada pembentukan nanopartikel seng sulfida. Dalam beberapa kasus, senyawa organik digunakan sebagai bahan penutup untuk mengontrol ukuran dan stabilitas partikel.
Seng sulfida juga dapat dibuat dengan mereaksikan logam seng dengan unsur belerang. Kedua zat dipanaskan bersama untuk memulai reaksi:
Zn(s) + S(s) → ZnS(s)
Metode ini memberikan keserbagunaan dalam memproduksi seng sulfida dengan berbagai sifat untuk aplikasi berbeda, seperti optoelektronik, bahan berpendar, dll.
Kegunaan Seng Sulfida
Seng sulfida menemukan berbagai aplikasi di berbagai industri karena sifatnya yang unik. Berikut kegunaan utamanya:
- Pelapis Optik: Transparansi seng sulfida di wilayah inframerah menjadikannya bahan berharga untuk pelapis optik, lensa, dan jendela dalam sistem dan sensor pencitraan termal.
- Bahan bercahaya: Ini berfungsi sebagai bahan utama untuk membuat senyawa bercahaya, seperti seng sulfida yang didoping tembaga untuk aplikasi bercahaya dalam gelap.
- Aplikasi Semikonduktor: Dalam transistor film tipis dan perangkat semikonduktor lainnya, film seng sulfida berperan dalam komponen elektronik.
- Fosfor tampilan LED: Tampilan LED menggunakan fosfor seng sulfida untuk meningkatkan warna dan kecerahan.
- Deteksi sinar X dan sinar gamma: Detektor kilau menggunakan sifat kilau seng sulfida untuk mendeteksi sinar X dan sinar gamma.
- Pigmen dan cat: Pigmen putih pada cat, pelapis dan tinta cetak menggunakan bentuk seng sulfida tertentu seperti seng putih atau lithopone.
- Penanda fluoresen: Dalam aplikasi biologis, peneliti memfungsikan nanopartikel seng sulfida untuk penanda fluoresen dalam studi pencitraan.
- Sel surya: Para ilmuwan sedang mempelajari nanopartikel seng sulfida untuk mengetahui potensinya dalam meningkatkan penyerapan cahaya dalam sel surya fotovoltaik.
- Katalisis: Menjelajahi sifat semikonduktornya, para peneliti mempelajari sifat katalitik seng sulfida dalam berbagai reaksi kimia.
- Jendela inframerah: Perangkat optik seperti kamera, teleskop, dan sensor yang menggunakan seng sulfida untuk jendela inframerah.
Fleksibilitas seng sulfida muncul dari kemampuannya menunjukkan sifat pendaran, transparansi, dan semikonduktor. Aplikasi yang dibuat khusus memberikan kontribusi signifikan pada bidang-bidang seperti optik, elektronik, energi, dan ilmu material.
Pertanyaan:
T: Apa rumus seng sulfida?
A: Rumus seng sulfida adalah ZnS.
T: Apakah seng sulfida larut?
A: Seng sulfida umumnya tidak larut dalam air.
Q: Apakah ZnS larut dalam air?
A: Tidak, ZnS tidak larut dalam air.
T: Seng sulfida mengandung 67,1% seng berdasarkan massa. Berapa fraksi massa belerang dalam seng sulfida?
A: Fraksi massa belerang dalam seng sulfida adalah 32,9%.
T: Bagaimana cara memisahkan seng klorida dari seng sulfida?
A: Seng klorida dan seng sulfida dapat dipisahkan dengan melarutkan seng klorida dalam air, sehingga seng sulfida yang tidak larut tertinggal.
T: Apakah seng sulfida bersifat ionik?
J: Ya, seng sulfida pada dasarnya bersifat ionik.
Q: Jenis cacat stoikiometri apa yang diwakili oleh ZnS?
A: Seng sulfida dapat menunjukkan cacat stoikiometri tipe Frenkel.
T: Apa itu ZnS?
A: ZnS adalah rumus kimia seng sulfida, senyawa seng dan belerang.
T: Berapa pH minimum yang diperlukan untuk mencegah pengendapan ZnS?
J: PH minimum yang diperlukan untuk mencegah pengendapan ZnS adalah sekitar 4,7.
Q: Gambar ini menunjukkan sel satuan kubik untuk ZnS. Berapa banyak ion Zn²⁺ yang ada dalam sel kubik ini?
A: Dalam sel kubik ZnS, terdapat empat ion Zn²⁺.
Q: Apakah ZnS bersifat ionik atau kovalen?
J: ZnS terutama dianggap ionik.
Q: Jenis reaksi apakah Zn + S = ZnS?
A: Reaksi Zn + S = ZnS merupakan reaksi sintesis atau kombinasi.
