Asam hidroiodik (HI) adalah asam kuat yang terbentuk dari hidrogen dan yodium. Ini digunakan dalam sintesis organik dan sebagai zat pereduksi. Ini sangat korosif dan memerlukan penanganan yang hati-hati.
| Nama IUPAC | Asam hidroiodik |
| Formula molekul | HAI |
| nomor CAS | 10034-85-2 |
| Sinonim | Asam hidroiodik, hidrogen iodida, iodana |
| Di ChI | InChI=1S/HI/h1H |
Sifat asam hidroiodik
Rumus Asam Hidroiodik
Rumus kimia hidrogen iodida adalah HI. Ini terdiri dari atom hidrogen (H) yang terikat pada atom yodium (I). Rumus sederhana ini mewakili komposisi asam kuat ini.
Massa Molar Asam Hidroiodik
Massa molar hidrogen iodida (HI) kira-kira 127,91 gram per mol (g/mol). Nilai ini dihitung dengan menjumlahkan massa atom atom hidrogen dan atom yodium.
Titik didih asam hidriodat
Hidrogen iodida memiliki titik didih yang relatif rendah, sekitar -35 derajat Celcius (-31 derajat Fahrenheit). Pada suhu ini, wujud cair HI berubah menjadi gas.
Titik lebur asam hidroiodik
Titik leleh hidrogen iodida kira-kira -51 derajat Celsius (-60 derajat Fahrenheit). Pada suhu ini, bentuk padat HI berubah menjadi cair.
Massa jenis asam hidroiodik g/mL
Massa jenis hidrogen iodida kira-kira 2,85 gram per mililiter (g/mL). Pengukuran massa jenis ini menunjukkan massa HI yang ada dalam satu mililiter zat.
Asam hidroiodik Berat molekul
Hidrogen iodida memiliki berat molekul sekitar 127,91 g/mol. Nilai ini merupakan penjumlahan dari berat atom hidrogen dan yodium dalam molekul HI.
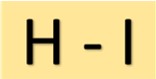
Struktur asam hidroiodik
Asam hidroiodik (HI) mempunyai struktur yang sederhana. Ini terdiri dari atom hidrogen yang dihubungkan ke atom yodium melalui ikatan kovalen tunggal. Susunan molekul ini memberikan sifat karakteristik pada HI.
Kelarutan asam hidroiodik
Asam hidroiodik memiliki kelarutan yang tinggi dalam air. Jika dicampur dengan air, mudah larut membentuk larutan tidak berwarna. Kelarutannya yang tinggi berkontribusi terhadap penggunaannya secara luas dalam berbagai aplikasi, termasuk sintesis kimia.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 2,85g/ml |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 127,91 g/mol |
| Kepadatan | 2,85g/ml |
| Titik fusi | -51°C (-60°F) |
| Titik didih | -35°C (-31°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Dapat larut, membentuk larutan tidak berwarna |
| Kelarutan | Larut dalam pelarut organik |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | -sepuluh |
| pH | Sangat asam (pH <1) |
Keamanan dan Bahaya Asam Hidroiodik
Hidrogen iodida (HI) menimbulkan risiko keselamatan yang signifikan karena sifatnya yang korosif. Ini dapat menyebabkan luka bakar kulit yang parah dan kerusakan mata jika terkena. Menghirup uapnya menyebabkan iritasi pernafasan. Peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata, harus digunakan saat menangani HI. Itu harus disimpan di tempat yang berventilasi baik, jauh dari zat yang tidak kompatibel. Jika tidak sengaja tertelan atau terhirup, segera dapatkan bantuan medis. Jika tumpah, netralkan dengan bahan yang sesuai dan buang sebagai limbah berbahaya. Penting untuk mengikuti protokol keselamatan yang ketat dan menanganinya dengan hati-hati untuk menghindari kecelakaan dan cedera.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Menyebabkan luka bakar kulit yang parah dan kerusakan mata. Berbahaya jika terhirup. |
| Nomor identifikasi PBB | UN1787 |
| kode HS | 28111990 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis asam hidroiodik
Hidrogen iodida (HI) dapat disintesis dengan berbagai metode. Pendekatan yang umum melibatkan reaksi langsung yodium (I2) dengan fosfor merah (P). Dalam metode ini, I2 dicampur dengan fosfor merah yang bertindak sebagai zat pereduksi. Reaksi berlangsung dengan adanya air, menghasilkan HI dan asam fosfat.
Metode lain melibatkan reaksi yodium dengan hidrazin hidrat (N2H4·H2O). Proses ini memerlukan penanganan yang hati-hati karena sifat hidrazin hidrat yang berpotensi berbahaya. Reaksi tersebut menghasilkan pembentukan HI dan gas nitrogen.
Alternatifnya, reaksi yodium dengan asam sulfat pekat (H2SO4) juga dapat menghasilkan HI. Dalam metode ini, yodium dicampur dengan asam sulfat pekat, menghasilkan gas HI, yang dapat dikumpulkan dan dikondensasi menjadi bentuk cair.
Penting untuk dicatat bahwa sintesis hidrogen iodida harus dilakukan dengan tindakan pencegahan keselamatan yang tepat. Bahan kimia yang terlibat bisa berbahaya dan reaksinya bisa menghasilkan gas beracun. Ventilasi yang baik, peralatan pelindung, dan kepatuhan terhadap tindakan pencegahan keselamatan sangat penting selama proses sintesis untuk memastikan produksi hidrogen iodida yang aman dan sukses.
Kegunaan Asam Hidroiodik
Hidrogen iodida (HI) banyak digunakan di berbagai industri karena sifatnya yang unik. Berikut adalah beberapa kegunaan utama:
- Sintesis organik: Kimia organik menggunakan HI sebagai reaktan penting untuk mengubah alkil halida menjadi alkana, suatu proses yang dikenal sebagai dehalogenasi.
- Industri Farmasi: Produksi berbagai senyawa farmasi, termasuk obat yang mengandung yodium dan zat kontras beryodium untuk pencitraan medis, terkait dengan HI.
- Zat pereduksi: HI secara aktif berfungsi sebagai zat pereduksi yang kuat dalam reaksi kimia, membantu mereduksi ion logam menjadi bentuk unsurnya.
- Katalisis: HI secara aktif berpartisipasi sebagai katalis dalam reaksi kimia tertentu, meningkatkan laju reaksi dan meningkatkan hasil transformasi spesifik.
- Pembersihan dan Pengetsaan: Industri elektronik dan semikonduktor secara aktif menggunakan HI untuk proses pembersihan dan pengetsaan karena kemampuannya melarutkan logam dan oksida logam.
- Kimia analitik: Titrasi iodometri dalam kimia analitik secara aktif menggunakan HI untuk menentukan konsentrasi zat tertentu berdasarkan reaksinya dengan yodium.
- Perawatan Permukaan Logam: HI secara aktif berperan dalam mempersiapkan permukaan logam untuk proses pelapisan, pematrian, dan perawatan permukaan lainnya.
- Manufaktur Iodida: Berbagai industri secara aktif menggunakan HI untuk memproduksi senyawa iodida untuk berbagai aplikasi di bidang seperti fotografi, kedokteran, dan sintesis organik.
- Reagen Laboratorium: Laboratorium secara aktif menggunakan HI sebagai reagen yang berguna untuk banyak reaksi kimia dan eksperimen.
Sifat serbaguna hidrogen iodida menjadikannya alat yang berharga dalam penelitian kimia, proses industri, dan pengembangan farmasi, berkontribusi terhadap kemajuan di berbagai sektor dan penemuan ilmiah.
Pertanyaan:
Q: Senyawa apa yang dapat ditambahkan pada asam hidriodat (HI) untuk menetralkan sifat asamnya?
A: Basa, seperti natrium hidroksida (NaOH), dapat ditambahkan untuk menetralkan hidrogen iodida dan membentuk air dan garam.
Q: Apakah asam hidroiodik termasuk asam kuat?
J: Ya, hidrogen iodida adalah asam kuat, yang berarti ia terionisasi sempurna di dalam air, melepaskan ion hidrogen.
Q: Apa rumus asam hidroiodik?
J: Rumus hidrogen iodida adalah HI, yang menyatakan atom hidrogen terikat pada atom yodium.
Q: Manakah rumus asam hidroiodik berikut ini?
A: Rumus hidrogen iodida adalah HI.
Q: Berapa mililiter asam hidriodat 0,550 M yang diperlukan untuk bereaksi dengan 10,00 ml 0,217 M CsOH?
J: Diperlukan sekitar 17,58 ml hidrogen iodida 0,550 M untuk bereaksi dengan 10,00 ml CsOH 0,217 M.
T: Apakah asam hidroiodik ilegal?
J: Hidrogen iodida sendiri tidak ilegal, namun penggunaan dan kepemilikannya mungkin diatur karena potensi bahayanya dan penggunaannya dalam aktivitas ilegal.
T: Apa bentuk hidrogen iodida dan magnesium sulfida?
A: Hidrogen iodida dan magnesium sulfida bereaksi membentuk gas hidrogen sulfida (H2S) dan garam magnesium iodida (MgI2).
T: Apa yang terjadi jika Anda mencampurkan hidrogen iodida dengan soda kue?
J: Ketika hidrogen iodida bereaksi dengan soda kue (natrium bikarbonat), menghasilkan karbon dioksida, air, dan natrium iodida.
T: Bagaimana cara kerja hidrogen iodida dalam air?
A: Hidrogen iodida terionisasi dalam air, melepaskan ion hidrogen (H+) dan ion iodida (I-), menghasilkan larutan yang sangat asam.
Q: Persamaan ionik bersih natrium hidroksida dan hidrogen iodida?
A: Persamaan ionik total untuk reaksi antara natrium hidroksida (NaOH) dan hidrogen iodida (HI) adalah Na+ + OH- + H+ + I- → Na+ + I- + H2O.
