Tembaga fluorida (CuF2) adalah senyawa yang terbuat dari tembaga dan fluor. Ini menunjukkan warna biru kehijauan dan dapat diterapkan di berbagai industri, termasuk elektronik dan katalisis.
| Nama IUPAC | Tembaga(II) fluorida |
| Formula molekul | CuF2 |
| nomor CAS | 7789-19-7 |
| Sinonim | Tembaga fluorida, Tembaga difluorida |
| Di ChI | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Sifat tembaga fluorida
Rumus Tembaga Fluorida
Rumus tembaga difluorida adalah CuF2. Terdiri dari satu atom tembaga (Cu) dan dua atom fluor (F). Senyawa ionik ini membentuk struktur kristal yang stabil akibat adanya tarikan elektrostatis antara ion tembaga bermuatan positif dan ion fluorida bermuatan negatif.
Massa Molar Tembaga Fluorida
Massa molar tembaga difluorida (CuF2) dihitung dengan menjumlahkan massa atom unsur penyusunnya. Tembaga memiliki massa molar sekitar 63,55 g/mol dan fluor memiliki massa molar sekitar 18,99 g/mol. Jika dijumlahkan, kita mendapatkan massa molar tembaga difluorida kira-kira 101,09 g/mol.
Titik didih tembaga fluorida
Tembaga difluorida tidak memiliki titik didih yang pasti, karena mengalami penguraian sebelum mencapai titik didih. Pada suhu tinggi, tembaga difluorida mulai terurai menjadi tembaga difluorida (CuF) dan gas fluor (F2). Oleh karena itu, dianggap tidak stabil secara termal.
Titik lebur tembaga fluorida
Tembaga difluorida memiliki titik leleh sekitar 840°C (1544°F). Pada suhu ini, kristal tembaga difluorida padat menyerap energi yang cukup untuk bertransisi menjadi bentuk cair, sehingga memungkinkannya digunakan dalam berbagai aplikasi suhu tinggi.
Massa jenis tembaga fluorida g/mL
Kepadatan tembaga difluorida kira-kira 4,23 g/mL. Nilai kepadatan ini menunjukkan bahwa tembaga difluorida adalah bahan yang relatif padat, yang mungkin berguna dalam aplikasi spesifik yang memerlukan kepadatan tinggi.
Berat Molekul Tembaga Fluorida
Berat molekul tembaga difluorida (CuF2) kira-kira 101,09 g/mol. Ini dihitung dengan menambahkan berat atom tembaga dan dua atom fluor yang ada dalam rumus.
Struktur tembaga fluorida
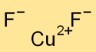
Tembaga difluorida mengadopsi struktur kristal, membentuk susunan kation Cu2+ dan anion F- seperti jaringan. Kation tembaga dikelilingi oleh enam ion fluorida dan setiap ion fluorida bersentuhan dengan tiga ion tembaga.
Kelarutan tembaga fluorida
Tembaga difluorida memiliki kelarutan yang rendah dalam air. Ini membentuk garam yang sukar larut yang melepaskan ion Cu2+ dan F- ke dalam larutan. Sifat ini penting dalam berbagai proses dan aplikasi kimia, termasuk sintesis anorganik dan aplikasi elektrokimia.
| Penampilan | Padat berwarna biru kehijauan |
| Berat jenis | 4,23g/ml |
| Warna | biru kehijauan |
| Bau | Tidak berbau |
| Masa molar | 101,09 g/mol |
| Kepadatan | 4,23 gram/cm³ |
| Titik fusi | 840°C (1544°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Lemah, membentuk garam yang sukar larut |
| Kelarutan | Sulit larut |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | Netral |
Keamanan dan bahaya tembaga fluorida
Tembaga difluorida menimbulkan beberapa pertimbangan keselamatan dan bahaya. Kontak langsung dengan senyawa ini dapat menyebabkan iritasi kulit dan mata. Menghirup debu atau asapnya dapat menyebabkan gangguan pernafasan. Jika dipanaskan, dapat melepaskan gas fluor beracun, yang berbahaya jika terhirup. Oleh karena itu, ventilasi yang memadai dan alat pelindung diri harus digunakan saat menangani tembaga difluorida. Selain itu, penting untuk menghindari konsumsi karena dapat menyebabkan gangguan pencernaan. Senyawa tersebut harus disimpan dalam wadah tertutup, jauh dari bahan yang tidak kompatibel untuk menghindari reaksi. Protokol keselamatan dan praktik penanganan yang tepat sangat penting untuk meminimalkan risiko yang terkait dengan tembaga difluorida.
| Simbol bahaya | Mengiritasi |
| Deskripsi Keamanan | Menyebabkan iritasi kulit dan mata. Berbahaya jika terhirup. Dapat melepaskan gas fluor beracun saat dipanaskan. Hindari menelan. Gunakan ventilasi dan peralatan pelindung yang sesuai. |
| Nomor identifikasi PBB | T/A |
| kode HS | 2826.92.00 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Beracun |
Metode sintesis tembaga fluorida
Ada berbagai metode untuk mensintesis tembaga difluorida. Pendekatan yang umum adalah menambahkan tembaga oksida (CuO) atau tembaga karbonat (CuCO3) ke dalam wadah dan aduk perlahan sambil menambahkan asam fluorida (HF) ke dalam wadah. Reaksi berlanjut, menghasilkan tembaga difluorida dan air sebagai produk sampingan.
Metode lain melibatkan mereaksikan logam tembaga atau bubuk tembaga dengan gas fluor (F2) pada suhu tinggi. Proses ini memerlukan penanganan yang hati-hati karena reaktivitas gas fluor. Ia membentuk tembaga difluorida secara langsung melalui kombinasi atom tembaga dan fluor.
Selain itu, pembuatan tembaga difluorida dapat terjadi dengan mereaksikan tembaga(II) klorida (CuCl2) dengan natrium fluorida (NaF) dalam larutan berair. Reaksi tersebut menghasilkan tembaga difluorida serta natrium klorida sebagai produk sampingan.
Metode sintesis ini memerlukan tindakan keselamatan dan peralatan yang sesuai karena reaktivitas beberapa bahan kimia yang terlibat. Kontrol yang tepat terhadap kondisi reaksi sangat penting untuk mendapatkan hasil tinggi dari tembaga difluorida murni.
Kegunaan tembaga fluorida
Tembaga difluorida memiliki beragam aplikasi berharga karena sifat dan karakteristiknya yang unik. Berikut adalah beberapa kegunaan utama:
- Elektronik: Tembaga difluorida digunakan dalam industri semikonduktor sebagai sumber ion tembaga untuk proses pengendapan film tipis. Ini berfungsi sebagai pelopor dalam pembuatan perangkat elektronik dan sirkuit terpadu.
- Katalisis: Ia bertindak sebagai katalis dalam berbagai reaksi kimia, termasuk sintesis senyawa organik dan dalam proses industri seperti reaksi fluorinasi.
- Sumber Fluor: Tembaga difluorida digunakan untuk menghasilkan gas fluor (F2) melalui dekomposisi suhu tinggi, yang penting untuk berbagai aplikasi industri.
- Keramik dan Kaca: Senyawa ini digunakan sebagai bahan tambahan dalam pembuatan keramik dan kaca untuk mengubah sifat material dan meningkatkan kinerjanya.
- Bahan gigi: Tembaga difluorida dimasukkan ke dalam produk gigi, seperti pasta gigi dan obat kumur, untuk meningkatkan sifat anti gigi berlubang dan antibakteri.
- Pelapis: Digunakan dalam pelapis khusus, seperti pelapis anti-reflektif untuk perangkat optik dan pelapis pelindung untuk permukaan logam.
- Penghambat Api: Tembaga difluorida digunakan sebagai aditif pada bahan tahan api, membantu mengurangi sifat mudah terbakar berbagai produk.
- Reagen Kimia: Di laboratorium dan penelitian, tembaga difluorida digunakan sebagai reagen dalam reaksi dan analisis kimia tertentu.
Fleksibilitas tembaga difluorida menjadikannya berharga di berbagai industri, mulai dari elektronik hingga perawatan kesehatan, dimana sifat uniknya dimanfaatkan untuk meningkatkan kinerja dan keselamatan. Namun, penanganan yang tepat dan tindakan pencegahan keselamatan sangat penting karena reaktivitas dan potensi bahayanya.
Pertanyaan:
Q: Apa rumus massa tembaga(II) fluorida?
A: Massa rumus tembaga(II) difluorida (CuF2) kira-kira 101,09 g/mol.
T: Manakah rumus berikut yang benar untuk tembaga(II) fluorida?
J: Rumus yang benar untuk tembaga(II) difluorida adalah CuF2.
T: Apakah tembaga membersihkan fluorida?
J: Tidak, tembaga tidak membersihkan difluorida. Tembaga tidak memiliki kemampuan untuk menghilangkan difluorida dari air.
Q: Apa senyawa kovalen dari NaCl, KCl, CuF2 dan CF4?
A: Senyawa kovalennya adalah CF4 (karbon tetrafluorida).
Q: Ketika larutan CuF2 dalam air dielektrolisis, apa yang terbentuk di elektroda?
A: Di anoda terbentuk gas oksigen (O2) dan di katoda terbentuk logam tembaga (Cu).
Q: Apa nama CuF2 di sistem Stok?
A: Nama CuF2 dalam sistem Stok adalah tembaga(II) difluorida.
Q: Berapa muatan ion tembaga dalam senyawa CuF2?
A: Muatan ion tembaga pada CuF2 adalah +2.
Q: Apakah CuF2 bersifat ionik atau molekuler?
J: CuF2 adalah senyawa ionik.
Q: Berapa muatan senyawa ionik CuF2?
A: Senyawa ionik CuF2 bersifat netral.
Q: Apa nama senyawa yang rumusnya CuF2?
A: Nama senyawa dengan rumus CuF2 adalah tembaga(II) difluorida.
