Tembaga nitrat (Cu(NO3)2) merupakan senyawa kristal berwarna biru yang digunakan di berbagai industri. Ini berfungsi sebagai katalis, zat pengoksidasi dan prekursor bahan tembaga dalam proses kimia.
| Nama IUPAC | Tembaga(II) nitrat |
| Formula molekul | Cu(NO3)2 |
| nomor CAS | 3251-23-8 |
| Sinonim | tembaga nitrat; Tembaga nitrat; Tembaga nitrat; Asam nitrat, garam tembaga (2+) |
| Di ChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Sifat tembaga nitrat
Formula Tembaga Nitrat
Rumus kimia kupri nitrat adalah Cu(NO3)2. Hal ini menunjukkan bahwa setiap molekul cupric nitrat mengandung satu ion tembaga (Cu) dan dua ion nitrat (NO3). Kehadiran ion tembaga(II) menunjukkan bilangan oksidasi +2 pada tembaga.
Massa Molar Tembaga Nitrat
Massa molar kupri nitrat dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Tembaga (Cu) memiliki massa molar sekitar 63,55 g/mol, sedangkan nitrat (NO3) memiliki massa molar sekitar 62,00 g/mol. Jadi, massa molar kupri nitrat kira-kira 187,55 g/mol.
Titik didih tembaga nitrat
Titik didih kupri nitrat mengacu pada suhu saat ia berubah dari cair menjadi gas di bawah tekanan atmosfer standar. Titik didih kupri nitrat umumnya di atas 100°C (212°F). Namun, penting untuk diperhatikan bahwa tembaga nitrat umumnya terurai sebelum mencapai titik didihnya.
Titik lebur tembaga nitrat
Titik leleh kupri nitrat adalah suhu perubahan wujud padat menjadi cair. Titik leleh kupri nitrat umumnya antara 256°C dan 260°C (493°F dan 500°F). Penting untuk menangani bahan ini dengan hati-hati untuk menghindari penguraiannya.
Massa jenis tembaga nitrat g/mL
Massa jenis kupri nitrat mengacu pada massa per satuan volume. Massa jenis kupri nitrat padat umumnya sekitar 2,32 g/mL, sedangkan massa jenis larutan berairnya dapat bervariasi bergantung pada konsentrasi.
Berat Molekul Tembaga Nitrat
Berat molekul kupri nitrat adalah jumlah berat atom seluruh atom dalam rumus kimianya. Untuk Cu(NO3)2, berat molekulnya kira-kira 187,55 g/mol.
Struktur tembaga nitrat
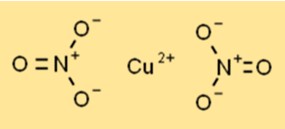
Cupric nitrate ada sebagai padatan kristal biru dengan struktur kristal heksagonal. Setiap ion tembaga (Cu2+) dikelilingi oleh enam atom oksigen dari dua ion nitrat, menciptakan susunan yang terkoordinasi. Struktur ini berkontribusi terhadap stabilitas dan reaktivitasnya dalam berbagai proses kimia.
Kelarutan tembaga nitrat
Cupric nitrate cukup larut dalam air. Ini membentuk larutan berair ketika dilarutkan dalam air, yang dapat digunakan dalam berbagai aplikasi seperti pelapisan listrik dan sebagai reagen dalam reaksi kimia. Namun kelarutannya menurun dengan semakin rendahnya suhu.
| Penampilan | Padatan kristal biru |
| Berat jenis | T/A |
| Warna | Biru |
| Bau | Tidak berbau |
| Masa molar | 187,55 g/mol |
| Kepadatan | 2,32 g/mL (padat) |
| Titik fusi | 256-260°C (493-500°F) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | T/A |
| Kelarutan dalam air | Cukup larut, membentuk larutan berair |
| Kelarutan | Larut dalam air |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | T/A |
| pH | Asam |
Keamanan dan bahaya tembaga nitrat
Cupric nitrate menimbulkan masalah keamanan dan bahaya tertentu. Penting untuk menangani senyawa ini dengan hati-hati. Kontak langsung dengan kulit atau mata dapat menyebabkan iritasi atau luka bakar. Menghirup debu atau asap dapat menyebabkan iritasi pernafasan. Saat dipanaskan, ia dapat melepaskan nitrogen oksida beracun. Zat ini juga merupakan zat pengoksidasi dan dapat menyulut bahan yang mudah terbakar jika bersentuhan. Peralatan pelindung yang tepat, seperti sarung tangan dan kacamata, harus dipakai saat bekerja dengan tembaga nitrat. Ini harus disimpan jauh dari bahan yang mudah terbakar dan bahan yang tidak kompatibel untuk meminimalkan potensi risiko. Selalu ikuti petunjuk keselamatan dan gunakan di area yang berventilasi baik.
| Simbol bahaya | Agen pengoksidasi, Korosif, Iritan |
| Deskripsi Keamanan | Tangani dengan deposit. Hindari kontak dengan kulit dan mata. Gunakan di area yang berventilasi baik. Jauhkan dari bahan yang mudah terbakar. |
| Nomor identifikasi PBB | UN3085 |
| kode HS | 28342910 |
| Kelas bahaya | 5.1 (Agen pengoksidasi) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Berbahaya jika tertelan. Dapat menyebabkan iritasi kulit dan mata. Menghirup debu atau asap dapat menyebabkan iritasi pernafasan. |
Metode sintesis tembaga nitrat
Ada beberapa metode untuk mensintesis tembaga nitrat.
Pendekatan umum melibatkan reaksi antara tembaga oksida (CuO) atau tembaga hidroksida (Cu(OH)2) dengan asam nitrat (HNO3) . Saat menyiapkan kupri nitrat, seseorang dapat menambahkan oksida kupri atau hidroksida kupri secara perlahan ke dalam larutan asam nitrat, sehingga menghasilkan pembentukan kupri nitrat dan air.
Metode lain melibatkan reaksi antara logam tembaga (Cu) dan asam nitrat pekat. Logam Cu bereaksi dengan asam nitrat menghasilkan kupri nitrat, nitrogen dioksida (NO2), dan air. Cara ini memerlukan penanganan yang hati-hati karena dapat terbentuk gas nitrogen dioksida yang beracun.
Alternatifnya, Anda dapat melarutkan logam tembaga atau oksida kupri dalam campuran asam nitrat dan hidrogen peroksida (H2O2) untuk menghasilkan kupri nitrat. Metode ini memungkinkan reaksi lebih cepat dan menghasilkan tembaga nitrat murni.
Terakhir, reaksi perpindahan ganda antara CuSO4 dan natrium nitrat (NaNO3) juga dapat menghasilkan kupri nitrat. Dengan mencampurkan kedua garam ini dalam air, endapan cupric nitrat dan produk sampingan natrium sulfat tetap larut.
Ikuti tindakan pencegahan keselamatan selama sintesis karena bahan kimia yang terlibat menunjukkan reaktivitas. Gunakan peralatan pelindung yang sesuai dan gunakan praktik laboratorium yang tepat untuk memastikan sintesis tembaga nitrat berhasil dan aman.
Kegunaan tembaga nitrat
Tembaga nitrat menemukan berbagai aplikasi di berbagai industri karena sifatnya yang unik. Beberapa kegunaan penting meliputi:
- Katalis: Bertindak sebagai katalis dalam sintesis organik, memfasilitasi reaksi seperti konversi alkohol menjadi aldehida atau keton.
- Kembang api: Tembaga nitrat adalah komponen kunci formulasi kembang api, yang berkontribusi terhadap warna api biru dan hijau.
- Pertanian: Di bidang pertanian, tembaga berfungsi sebagai sumber tembaga dalam pupuk untuk menyediakan nutrisi penting bagi tanaman.
- Agen pengoksidasi: Tembaga nitrat secara aktif mengoksidasi zat lain selama proses kimia.
- Pelapisan Logam: Tembaga nitrat secara aktif mengendapkan lapisan tipis Cu pada berbagai permukaan logam selama proses pelapisan listrik.
- Pigmen dan Pewarna: Tembaga nitrat secara aktif berkontribusi terhadap penciptaan pigmen hijau dan biru untuk keramik, kaca, dan tekstil.
- Proses fotografi: tembaga nitrat secara aktif berkontribusi terhadap pengembangan gambar dalam solusi fotografi tertentu.
- Pengawetan: Dapat diterapkan dalam pengawetan kayu dengan membantu memperbaiki bahan pengawet.
- Pembuatan senyawa tembaga lainnya: Berfungsi sebagai prekursor untuk sintesis berbagai bahan dan senyawa berbasis tembaga.
Fleksibilitas dan reaktivitas tembaga nitrat menjadikannya bahan kimia yang berharga dalam berbagai bidang, mulai dari proses industri hingga aplikasi artistik.
Pertanyaan:
T: Apa yang terjadi jika tembaga nitrat dipanaskan?
A: Saat dipanaskan, kupri nitrat terurai menjadi oksida kupri, gas nitrogen dioksida, dan oksigen.
Q: Apakah tembaga nitrat larut dalam air?
A: Ya, cupric nitrate cukup larut dalam air.
Q: Apa rumus kimia tembaga nitrat?
A: Rumus kimia kupri nitrat adalah Cu(NO3)2.
T: Apakah tembaga nitrat merupakan elektrolit kuat?
J: Ya, cupric nitrate adalah elektrolit kuat, yang terdisosiasi menjadi ion ketika dilarutkan dalam air.
Q: Berapakah muatan tembaga nitrat?
A: Tembaga nitrat memiliki muatan bersih 0; itu adalah senyawa netral.
Q: Berapa jumlah atom nitrogen dalam 10,2 g tembaga(II) nitrat?
J: Terdapat sekitar 0,161 mol kupri(II) nitrat, dan karenanya terdapat sekitar 0,322 mol atom nitrogen.
Q: Berapa banyak perak yang dapat dihasilkan dari 3,00 mol tembaga dan 3,85 mol perak nitrat?
J: 342,3 g perak dapat diproduksi, mengikuti persamaan kimia seimbang.
T: Apakah tembaga nitrat larut?
A: Ya, cupric nitrate larut dalam air.
Q: Apa rumus tembaga(II) nitrat?
A: Rumus kupri(II) nitrat adalah Cu(NO3)2.
Q: Apa yang dihasilkan oleh reaksi penggantian Cu(NO3)2 dan Zn?
A: Seng nitrat (Zn(NO3)2) dan logam tembaga (Cu) dihasilkan dalam reaksi penggantian.
Q: Apa itu Cu(NO3)2?
A: Cu(NO3)2 adalah rumus kimia kupri nitrat, senyawa kristal biru.
Q: Manakah reaksi berikut yang mengalami reduksi? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
A: Tembaga (Cu) tereduksi selama reaksi, memperoleh elektron untuk membentuk logam tembaga.
Q: Apakah padatan Cu(OH)2 terbentuk ketika 0,075 g KOH dilarutkan dalam 1,0 L Cu(NO3)2 1,0 × 10⁻³ M?
A: Tidak, padatan Cu(OH)2 tidak terbentuk karena Cu(NO3)2 terionisasi sempurna dalam larutan dan terdapat kelebihan ion OH⁻ dari KOH.
