Litium oksida (Li2O) adalah senyawa yang terbuat dari litium dan oksigen. Ini menunjukkan sifat ionik yang kuat dan banyak digunakan dalam baterai karena potensi elektrokimianya yang tinggi.
| Nama IUPAC | Litium oksida |
| Formula molekul | Li2O |
| nomor CAS | 12142-77-7 |
| Sinonim | Litium(I) oksida; Dilitium oksida; litia; oksolitium; UNII-06T3K8P3KU |
| Di ChI | InChI=1S/2Li.O |
Rumus Litium Oksida
Rumus Litium Oksida
Rumus kimia dilitium oksida adalah Li2O. Ini mewakili kombinasi dua atom litium (Li) dan satu atom oksigen (O). Senyawa sederhana dan stabil ini penting dalam berbagai aplikasi industri.
Massa Molar Litium Oksida
Massa molar Li2O kira-kira 29,88 g/mol. Ini dihitung dengan menambahkan massa atom dua atom litium (masing-masing 6,94 g/mol) dan satu atom oksigen (16,00 g/mol).
Titik didih litium oksida
Dilithium oksida memiliki titik didih yang mengesankan sekitar 2.463 derajat Celsius (4.465 derajat Fahrenheit). Titik didih yang sangat tinggi ini membuatnya berguna dalam industri yang membutuhkan ketahanan panas yang ekstrim.
Titik Leleh Litium Oksida
Titik leleh dilitium oksida kira-kira 1.450 derajat Celcius (2.642 derajat Fahrenheit). Ketika terkena suhu ini, ia berubah dari wujud padat menjadi cair, sehingga memudahkan berbagai proses manufaktur.
Massa jenis litium oksida g/mL
Dilithium oksida memiliki kepadatan sekitar 2,01 g/mL. Nilai ini mewakili massa senyawa per satuan volume dan penting untuk menentukan sifat dan penerapannya.
Berat Molekul Litium Oksida
Berat molekul Li2O adalah 29,88 g/mol. Ini adalah jumlah berat atom unsur penyusunnya, litium dan oksigen. Nilai ini memudahkan perhitungan stoikiometri.
Struktur litium oksida
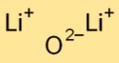
Dilithium oksida memiliki struktur kristal ionik sederhana. Ini terdiri dari kation litium (Li+) dan anion oksida (O2-) yang disatukan oleh gaya elektrostatis yang kuat. Pengaturan ini berkontribusi terhadap stabilitas dan konduktivitasnya.
Kelarutan litium oksida
Dilithium oksida memiliki kelarutan yang rendah dalam air. Bereaksi dengan air untuk membentuk litium hidroksida, membatasi pembubarannya. Namun, ia menunjukkan kelarutan tertentu dalam beberapa pelarut tidak berair dan garam cair.
Kesimpulannya, dilithium oksida merupakan senyawa penting dengan berbagai karakteristik dan aplikasi. Strukturnya yang stabil, titik leleh dan titik didih yang tinggi menjadikannya berharga dalam industri seperti keramik, manufaktur kaca, dan sebagai komponen baterai khusus. Memahami sifat-sifatnya memungkinkan kita memanfaatkan potensinya untuk berbagai tujuan.
| Penampilan | Padatan putih |
| Berat jenis | 2,01 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 29,88 g/mol |
| Kepadatan | 2,01 gram/ml |
| Titik fusi | 1.450°C (2.642°F) |
| Titik didih | 2463°C (4465°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan air |
| Kelarutan | Kelarutan dalam air buruk, bentuk litium hidroksida |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Harap dicatat bahwa beberapa sifat seperti titik nyala, tekanan uap, kepadatan uap, pKa dan pH tidak berlaku atau tersedia untuk Li2O karena sifat dan perilaku kimianya.
Keamanan dan Bahaya Litium Oksida
Dilithium oksida menimbulkan masalah keamanan dan bahaya tertentu. Bereaksi kuat dengan air, menghasilkan litium hidroksida, yang bersifat kaustik dan dapat menyebabkan iritasi kulit dan mata. Menghirup debu atau asapnya dapat menyebabkan iritasi pernafasan. Senyawa ini tidak tergolong sangat beracun tetapi harus ditangani dengan hati-hati untuk menghindari kontak dengan kulit atau mata. Ventilasi yang baik dan peralatan pelindung diri sangat penting saat bekerja dengan dilithium oksida. Jika tertelan secara tidak sengaja, perhatian medis segera diperlukan. Selain itu, produk ini harus disimpan jauh dari bahan yang tidak kompatibel untuk menghindari potensi risiko kebakaran atau ledakan.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Bereaksi dengan air. Menyebabkan iritasi kulit dan mata. Tangani dengan hati-hati. Hindari menghirup debu atau asap. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2825.70.00 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Tidak terlalu beracun, tetapi diperlukan kehati-hatian. Hindari tertelan dan kontak dengan kulit atau mata. |
Metode Sintesis Litium Oksida
Berbagai metode memungkinkan sintesis dilitium oksida.
Pendekatan umum melibatkan mereaksikan logam litium dengan oksigen atau udara pada suhu tinggi. Dalam proses ini, gas oksigen memfasilitasi pemanasan logam litium, sehingga menghasilkan pembentukan dilitium oksida.
Metode lainnya adalah dekomposisi termal garam litium, seperti litium karbonat atau litium hidroksida , pada suhu tinggi. Dengan memanaskan garam-garam ini, mereka terurai menghasilkan dilitium oksida.
Selain itu, untuk menghasilkan dilitium oksida, litium hidroksida dapat digunakan sebagai prekursor. Pertama-tama mengalami dehidrasi dengan pemanasan, mengubahnya menjadi bentuk oksida yang diinginkan.
Teknik lain melibatkan penggunaan mineral atau bijih yang mengandung litium. Proses kimia mengekstraksi senyawa litium dari sumber alami ini, yang selanjutnya mengalami pemrosesan lebih lanjut untuk menghasilkan dilitium oksida.
Penting untuk dicatat bahwa setiap metode sintesis mungkin memiliki kelebihan dan tantangan spesifik dalam hal biaya, efisiensi dan kemurnian. Para ilmuwan dan insinyur mempertimbangkan faktor-faktor ini ketika memilih metode yang paling tepat untuk memproduksi dilithium oksida untuk memenuhi persyaratan industri atau penelitian tertentu.
Kegunaan Litium Oksida
Dilithium oksida (Li2O) dapat digunakan secara serbaguna di berbagai industri karena sifatnya yang unik. Berikut adalah beberapa kegunaan utama:
- Industri keramik: Dilithium oksida adalah komponen penting keramik, meningkatkan kekuatan mekanik dan stabilitas termal. Ini juga mengurangi suhu memasak, menghemat energi selama proses pembuatan.
- Produksi kaca: Dalam industri kaca, dilithium oksida bertindak sebagai fluks, menurunkan suhu leleh kaca dan meningkatkan ketahanannya terhadap serangan kimia, sehingga menghasilkan produk kaca berkualitas tinggi.
- Teknologi baterai: Dilithium oksida berfungsi sebagai pendahulu dalam produksi baterai lithium-ion. Ini berkontribusi pada bahan katoda baterai, sehingga meningkatkan kapasitas penyimpanan energi dan kinerja keseluruhan.
- Desikan: Afinitas kuat Dilithium oksida terhadap air menjadikannya pengering yang efektif, digunakan untuk menghilangkan kelembapan dari lingkungan tertentu, seperti pada sistem AC dan pemurnian gas.
- Metalurgi: Dalam proses metalurgi, dilithium oksida membantu pemurnian logam dengan menghilangkan kotoran.
- Kacamata Khusus: Produksi kacamata khusus untuk berbagai aplikasi, seperti optik, elektronik, dan instrumen ilmiah, melibatkan penggunaan dilithium oksida.
- Katalis: Dilithium oksida berfungsi sebagai katalis dalam reaksi kimia tertentu, memfasilitasi transformasi reaktan menjadi produk yang diinginkan.
- Industri nuklir: Dalam industri nuklir, dilithium oksida berfungsi sebagai moderator neutron, mengendalikan laju reaksi fisi nuklir.
Keragaman aplikasi menyoroti pentingnya dilithium oksida dalam kemajuan teknologi, manufaktur, dan penelitian ilmiah. Sifat uniknya terus mendorong inovasi di berbagai industri, menjadikannya senyawa berharga dengan beragam kegunaan praktis.
Pertanyaan:
Q: Persamaan apa yang menunjukkan bahwa litium oksida terbentuk dari reaksi antara oksigen dan litium?
J: 4Li + O2 → 2Li2O
Q: Berapa massa molar litium oksida, Li2O?
J: Massa molar Li2O kira-kira 29,88 g/mol.
T: Apa rumus litium oksida?
A: Rumus dilitium oksida adalah Li2O.
T: Apakah litium oksida bersifat ionik atau kovalen?
J: Dilitium oksida bersifat ionik.
Q: Berapa bilangan oksidasi litium dalam ikatan ionik?
A: Bilangan oksidasi litium dalam ikatan ionik adalah +1.
Q: Bilangan koordinasi litium dalam Li2O?
A: Bilangan koordinasi litium dalam Li2O adalah 4.
T: Apakah Li2O bersifat ionik atau kovalen?
J: Li2O bersifat ionik.
Q: Manakah dari reaksi berikut yang berhubungan dengan energi kisi Li2O (ΔH°latt)?
A: Reaksi: Li+(g) + O2-(g) → Li2O(s)
Q: Berapa massa molar litium oksida, Li2O?
J: Massa molar Li2O kira-kira 29,88 g/mol.
T: Manakah dari berikut ini yang akan dihasilkan ketika logam litium (Li) dibakar? O2, LiO, H2O, Li2O?
A: Li2O akan dihasilkan selama pembakaran logam litium (Li).
Q: Berapa gram dalam 4,5 mol Li2O?
J: Terdapat sekitar 134,46 gram dalam 4,5 mol Li2O.
