Nikel nitrat (Ni(NO₃)₂) adalah senyawa kimia yang mengandung ion nikel dan nitrat. Ia larut dalam air dan sering digunakan dalam katalis, pelapisan listrik dan sebagai prekursor senyawa nikel lainnya.
| Nama IUPAC | Nikel Dinitrat |
| Formula molekul | Ni(TIDAK₃)₂ |
| nomor CAS | 13138-45-9 |
| Sinonim | Nikel (II) nitrat, nikel nitrat, Dinitronickel, nikel bis (nitrat) |
| Di ChI | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Sifat nikel nitrat
Formula Nikel Nitrat
Rumus kimia nikel dinitrat adalah Ni(NO₃)₂. Ini mewakili senyawa yang terdiri dari kation nikel (Ni) dan anion nitrat (NO₃). Subskrip “2” pada rumus menunjukkan bahwa terdapat dua ion NO3- untuk setiap kation Ni+2.
Massa Molar Nikel Nitrat
Massa molar nikel dinitrat dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Nikel (Ni) memiliki massa molar sekitar 58,69 g/mol, sedangkan nitrat (NO₃) memiliki massa molar sekitar 62,00 g/mol. Jika dijumlahkan, massa molar nikel dinitrat kira-kira 182,69 g/mol.
Titik didih nikel nitrat
Titik didih nikel dinitrat mengacu pada suhu saat ia berubah dari cair menjadi gas. Titik didih nikel dinitrat kira-kira 136,7 derajat Celcius (278,06 derajat Fahrenheit). Namun, penting untuk dicatat bahwa nilai ini mungkin sedikit berbeda tergantung pada kemurnian senyawa.
Titik Leleh Nikel Nitrat
Titik leleh nikel dinitrat adalah suhu perubahan wujud padat menjadi cair. Titik leleh nikel dinitrat kira-kira 56,7 derajat Celcius (134,06 derajat Fahrenheit). Seperti halnya titik didih, titik leleh juga dapat dipengaruhi oleh kemurnian senyawa.
Massa jenis nikel nitrat g/mL
Massa jenis nikel dinitrat adalah ukuran massa per satuan volume. Nikel dinitrat memiliki kepadatan sekitar 1,68 g/mL. Nilai tersebut menunjukkan lebih padat dibandingkan air yang mempunyai massa jenis 1 g/mL.
Berat Molekul Nikel Nitrat
Berat molekul nikel dinitrat adalah jumlah berat atom seluruh atom yang ada dalam rumus kimianya. Seperti disebutkan sebelumnya, berat molekul nikel dinitrat adalah sekitar 182,69 g/mol.
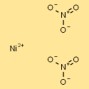
Struktur nikel nitrat
Struktur nikel dinitrat dapat divisualisasikan sebagai kation nikel (Ni²⁺) yang dikelilingi oleh dua anion nitrat (NO₃⁻) per kation. Ion nitrat membentuk ikatan terkoordinasi dengan kation nikel, menghasilkan senyawa ionik yang stabil.
Kelarutan nikel nitrat
Nikel dinitrat sangat larut dalam air dan membentuk larutan bening berwarna biru kehijauan. Kelarutannya dalam air merupakan sifat penting karena membuatnya mudah digunakan dalam berbagai aplikasi, seperti katalis, pelapisan listrik, dan produksi senyawa nikel lainnya.
| Penampilan | Padat berwarna biru kehijauan |
| Berat jenis | 1,68g/ml |
| Warna | biru kehijauan |
| Bau | Tidak berbau |
| Masa molar | 182,69 g/mol |
| Kepadatan | 1,68g/ml |
| Titik fusi | 56,7°C |
| Titik didih | 136,7°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air dan pelarut organik seperti etanol |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Netral (sekitar 7) |
Harap dicatat bahwa beberapa properti mungkin tidak tersedia atau relevan untuk nikel diitrat.
Keamanan dan Bahaya Nikel Nitrat
Nikel dinitrat menimbulkan beberapa risiko keselamatan dan kehati-hatian harus dilakukan saat menanganinya. Kontak langsung dengan senyawa ini dapat menyebabkan iritasi kulit dan mata. Menghirup debu atau asapnya dapat menyebabkan iritasi pernafasan. Penting untuk mengenakan peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata pengaman, saat bekerja dengan nikel dinitrat. Hindari konsumsi karena dapat berbahaya bagi kesehatan. Jika terjadi paparan yang tidak disengaja, segera dapatkan bantuan medis. Selain itu, penyimpanan yang tepat di area yang berventilasi baik, jauh dari bahan yang tidak kompatibel, sangat penting untuk meminimalkan potensi risiko dan memastikan penanganan yang aman.
| Simbol bahaya | Korosif, Iritasi, Bahaya kesehatan |
| Deskripsi Keamanan | Menyebabkan iritasi kulit dan mata. Berbahaya jika terhirup atau tertelan. Tangani dengan hati-hati. Hindari kontak langsung. Gunakan peralatan pelindung. |
| Nomor identifikasi PBB | UN2724 |
| kode HS | 2834.2990 |
| Kelas bahaya | 5.1 (Zat pengoksidasi) |
| Kelompok pengepakan | II |
| Toksisitas | Cukup beracun |
Metode sintesis nikel nitrat
Ada beberapa metode untuk mensintesis nikel dinitrat. Metode yang umum melibatkan reaksi antara nikel oksida (NiO) atau nikel hidroksida (Ni(OH)₂) dengan asam nitrat (HNO₃). Selama proses ini, nikel oksida atau nikel hidroksida larut dalam asam nitrat, menghasilkan pembentukan nikel dinitrat dan air sebagai produk sampingan.
Reaksinya dapat mengambil representasi berikut:
- Dengan nikel oksida: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- Dengan nikel hidroksida: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
Pendekatan lain melibatkan reaksi antara nikel metalik dan asam nitrat pekat, yang menghasilkan pembentukan nikel dinitrat dan gas nitrogen dioksida (NO₂) sebagai produk sampingan:
- Dengan Logam Nikel: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
Penting untuk melakukan reaksi-reaksi ini dalam kondisi yang terkontrol karena asam nitrat merupakan oksidator kuat dan dapat berbahaya. Pastikan hasil yang aman dan sukses selama proses sintesis dengan secara aktif menerapkan tindakan dan peralatan keselamatan yang sesuai. Selain itu, pilihan reagen dan kondisi reaksi dapat bervariasi tergantung pada aplikasi spesifik dan sifat yang diinginkan dari produk nikel dinitrat.
Kegunaan Nikel Nitrat
Nikel dinitrat banyak digunakan di berbagai industri karena sifatnya yang unik. Berikut beberapa kegunaan utamanya:
- Pelapisan listrik: Nikel dinitrat memungkinkan pengendapan lapisan tipis nikel pada berbagai logam, meningkatkan ketahanan terhadap korosi dan penampilan selama proses pelapisan listrik.
- Katalis: Ini memainkan peran penting sebagai katalis dalam reaksi kimia, memfasilitasi konversi reaktan menjadi produk yang diinginkan, terutama dalam sintesis organik.
- Keramik: Industri keramik menggunakan nikel dinitrat untuk memberikan pewarnaan spesifik dan meningkatkan kinerja bahan keramik.
- Industri Kaca: Produsen di industri kaca menggunakan nikel dinitrat untuk menghasilkan kaca berwarna dengan sifat optik yang diinginkan.
- Produksi baterai: Produsen menggunakan nikel dinitrat dalam produksi baterai berbasis nikel, termasuk baterai nikel-metal hidrida (NiMH).
- Sel Bahan Bakar: Nikel dinitrat bertindak sebagai prekursor dalam pembuatan elektroda oksida nikel untuk sel bahan bakar oksida padat (SOFC).
- Kembang api: Dalam kembang api, nikel dinitrat berfungsi sebagai oksidan, menghasilkan nyala api hijau pada kembang api.
- Reagen Kimia: Berfungsi sebagai reagen dalam berbagai reaksi kimia, terutama yang melibatkan kompleks nikel.
- Pupuk: Di bidang pertanian, nikel dinitrat kadang-kadang digunakan sebagai sumber nikel dalam pupuk untuk mengatasi kekurangan nikel pada tanaman tertentu.
Beragamnya penerapan nikel dinitrat di berbagai industri menyoroti pentingnya nikel dinitrat sebagai senyawa serbaguna dengan beragam kegunaan praktis.
Pertanyaan:
Q: Ketika larutan amonium fosfat dan nikel(ii) nitrat dicampur, endapan apa yang terjadi?
A: Nikel(II) fosfat mengendap.
Q: Berapa molaritas larutan yang mengandung 5,8 gram nikel nitrat dalam 500 ml?
Jawaban: Molaritasnya adalah 0,2 M.
T: Berapa panjang gelombang yang diserap nikel nitrat?
A: Nikel dinitrat menyerap panjang gelombang di daerah ultraviolet dan daerah tampak.
T: Apakah nikel II nitrat larut?
J: Ya, nikel(II) dinitrat larut dalam air.
Q: Apa rumus nikel II nitrat?
J: Rumusnya adalah Ni(NO₃)₂.
T: Apa warna nikel II nitrat?
A: Warna nikel(II) dinitrat adalah biru kehijauan.
Q: Berapa jumlah atom nitrogen dalam rumus kimia Ni(NO₃)₂?
J: Ada empat atom nitrogen.
Q: Apakah Ni(NO₃)₂ larut dalam air?
A: Ya, Ni(NO₃)₂ larut dalam air.
Q: Senyawa C4H10, BaCl2, Ni(NO₃)₂, SF6 manakah yang harus ada dalam satuan rumus?
J: C4H10 (butana) dan SF6 (sulfur heksafluorida) harus ada sebagai satuan formula. BaCl2 dan Ni(NO₃)₂ merupakan senyawa ionik.
