Timbal oksida (PbO) adalah senyawa yang terbuat dari timbal dan oksigen. Ini digunakan dalam produksi baterai, keramik dan kaca karena sifat dan aplikasinya yang berbeda.
| Nama IUPAC | Timbal(II) oksida |
| Formula molekul | PbO |
| nomor CAS | 1317-36-8 |
| Sinonim | Timbal monoksida, timbal (II) oksida, litharge |
| Di ChI | InChI=1S/2O.Pb |
Sifat oksida timbal
Formula Timbal Oksida
Rumus kimia timbal monoksida adalah PbO. Ini terdiri dari atom timbal (Pb) dan atom oksigen (O), menghasilkan struktur molekul yang sederhana dan terdefinisi dengan baik.
Massa Molar Timbal Oksida
Massa molar timbal monoksida (PbO) kira-kira 223,2 gram per mol (g/mol). Nilai ini diperoleh dengan menjumlahkan massa atom atom timbal dan atom oksigen.
Titik didih timbal oksida
Timbal monoksida tidak memiliki titik didih yang jelas karena mengalami penguraian sebelum mencapai titik didihnya. Ketika dipanaskan, ia berubah menjadi logam timbal dan gas oksigen.
Titik leleh timbal oksida
Titik leleh timbal monoksida (PbO) kira-kira 888°C (1.630°F). Pada suhu ini, timbal monoksida padat berubah menjadi cairan cair, sehingga memudahkan berbagai aplikasi industri.
Kepadatan timbal oksida g/mL
Timbal monoksida memiliki kepadatan sekitar 9,53 gram per mililiter (g/mL). Kepadatan tinggi ini membuatnya berguna dalam berbagai industri seperti produksi keramik dan kaca.
Berat Molekul Timbal Oksida
Berat molekul timbal monoksida (PbO) adalah 223,2 g/mol. Nilai ini mewakili jumlah massa atom timbal dan oksigen dalam satu molekul timbal monoksida.
Struktur timbal oksida
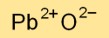
Timbal monoksida memiliki struktur kisi kristal, dengan kation timbal (Pb2+) menempati posisi pada kisi dan anion oksida (O2-) mengisi ruang interstisial. Susunan ini menghasilkan ikatan ionik yang stabil.
Kelarutan timbal oksida
Timbal monoksida (PbO) memiliki kelarutan yang rendah dalam air. Ia hanya larut sedikit dalam air, membentuk larutan basa melalui hidrolisis kation timbal. Kelarutannya dapat meningkat dalam lingkungan asam.
| Penampilan | Bubuk kuning atau merah |
| Berat jenis | 9,53 gram/ml |
| Warna | Kuning atau merah |
| Bau | Tidak berbau |
| Masa molar | 223,2 g/mol |
| Kepadatan | 9,53 gram/cm³ |
| Titik fusi | 888°C (1630°F) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedikit larut |
| Kelarutan | Kelarutan rendah, dapat meningkat dalam lingkungan asam |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | Dasar (dalam larutan air) |
Keamanan dan Bahaya Timbal Oksida
Timbal monoksida berpotensi menimbulkan bahaya keselamatan dan memerlukan penanganan yang hati-hati. Menghirup atau menelan debu atau uap timbal monoksida dapat menyebabkan keracunan timbal, yang berdampak negatif pada sistem saraf dan organ. Ventilasi yang memadai dan peralatan pelindung diri sangat penting saat menangani senyawa ini. Hindari kontak dengan mata, kulit atau pakaian untuk menghindari iritasi. Selain itu, timbal monoksida berbahaya bagi kehidupan akuatik dan lingkungan; pembuangannya ke badan air harus benar-benar dihindari. Metode penyimpanan dan pembuangan yang tepat harus diikuti untuk meminimalkan risiko. Selalu ikuti petunjuk keselamatan dan tindakan peraturan saat bekerja dengan timbal monoksida.
| Simbol bahaya | Bahaya kesehatan |
| Deskripsi Keamanan | – Menghirup atau menelan dapat menyebabkan keracunan timbal dan kerusakan organ. – Hindari kontak dengan mata dan kulit untuk menghindari iritasi. – Tangani dengan ventilasi yang memadai dan alat pelindung diri. Hindari pelepasan ke lingkungan. Ikuti instruksi keselamatan. |
| Nomor identifikasi PBB | UN3077 |
| kode HS | 2824.90.7000 |
| Kelas bahaya | 9 (Bahan dan benda berbahaya lainnya) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Beracun bagi kehidupan akuatik dengan efek jangka panjang. |
Metode Sintesis Timbal Oksida
Sintesis timbal monoksida melibatkan beberapa metode. Pendekatan umum mencakup dekomposisi termal timbal nitrat, yaitu memanaskan timbal nitrat (Pb(NO3)2) hingga suhu tertentu. Proses ini memecah timbal nitrat menjadi timbal monoksida (PbO), nitrogen dioksida (NO2), dan gas oksigen (O2). Reaksi kimia mewakili:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Metode lain melibatkan oksidasi timbal logam. Timbal logam bereaksi dengan oksigen menghasilkan timbal monoksida:
2 Pb + O2 → 2 PbO
Selain itu, korosi pada timbal dalam kondisi asam menghasilkan timbal monoksida. Dalam skenario ini, timbal bereaksi dengan oksigen dan air menghasilkan timbal monoksida:
2 Pb + 2 H2O + O2 → 2 PbO + 2 H2O
Metode ini sangat penting dalam memproduksi timbal monoksida untuk berbagai aplikasi, seperti pembuatan baterai, keramik, dan pigmen. Namun, penting untuk menangani senyawa timbal dengan hati-hati karena potensi risikonya terhadap kesehatan dan lingkungan.
Kegunaan timbal oksida
Timbal monoksida banyak digunakan di berbagai industri karena sifatnya yang unik. Berikut kegunaan umumnya:
- Keramik: Bertindak sebagai aliran dalam produksi keramik, meningkatkan karakteristik leleh dan kualitas bahan keramik secara keseluruhan.
- Proteksi Radiasi: Kepadatannya yang tinggi dan efisiensinya dalam menyerap radiasi menjadikan timbal monoksida sebagai bahan yang cocok untuk proteksi radiasi di fasilitas medis dan industri nuklir.
- PVC Stabilizer : Berfungsi sebagai penstabil panas dan pelumas dalam pengolahan bahan polyvinyl klorida (PVC), membantu dalam pembuatan pipa PVC, kabel dan produk lainnya.
- Perangkat semikonduktor: Ini berfungsi sebagai bahan di beberapa perangkat semikonduktor, seperti varistor timbal monoksida, yang digunakan untuk perlindungan lonjakan arus.
- Baterai timbal-asam: Baterai timbal-asam menggunakan timbal monoksida sebagai komponen penting, sehingga memberikan sifat yang diperlukan untuk digunakan pada kendaraan, catu daya cadangan, dan sumber daya yang tidak pernah terputus.
- Produksi Kaca: Timbal monoksida memainkan peran penting dalam produksi kaca timbal, memberikan peningkatan indeks bias dan kecemerlangan, sehingga cocok untuk tujuan dekoratif dan optik.
- Aplikasi Pigmen: Cat dan pelapis mendapat manfaat dari berbagai pigmen berbahan dasar timbal, seperti minium (Pb3O4), karena warnanya yang cerah dan tahan cuaca.
- Penggunaan dalam industri karet: Industri karet menggunakan timbal monoksida sebagai akselerator dan bahan vulkanisasi, yang secara efektif meningkatkan sifat dan daya tahan produk karet.
Meskipun timbal monoksida memiliki kegunaan yang penting dalam industri, penting untuk menanganinya dengan hati-hati karena potensi risikonya terhadap kesehatan dan lingkungan. Tindakan dan peraturan keselamatan yang tepat sangat penting untuk memastikan penggunaannya secara bertanggung jawab di berbagai industri.
Pertanyaan:
T: Manakah dari persamaan berikut yang merupakan persamaan setara yang mewakili penguraian timbal(IV) oksida?
A: Persamaan setara penguraian timbal(IV) oksida adalah PbO2 → PbO + O2.
T: Apa rumus kimia timbal(IV) oksida?
A: Rumus kimia timbal(IV) oksida adalah PbO2.
Q: Berapa gram timbal(II) oksida yang akan dihasilkan dari 86,5 gram kalium iodida?
A: Untuk menentukan gram timbal(II) oksida yang dihasilkan, kita memerlukan persamaan reaksi kimia yang melibatkan kalium iodida dan PbO.
T: Apa itu timbal monoksida?
J: Timbal monoksida mengacu pada senyawa apa pun yang mengandung timbal dan oksigen, dan terdapat dalam beberapa bentuk, termasuk timbal(II) oksida (PbO) dan timbal(IV) oksida (PbO2).
Q: 0,632 mol timbal dioksidasi menjadi timbal(II) nitrat. Berapa mol perak yang akan diendapkan?
J: Untuk menghitung mol perak yang diendapkan, kita memerlukan persamaan kimia seimbang yang menyatakan reduksi timbal(II) nitrat menjadi perak.
T: Apa nama PbO?
A: Nama PbO adalah timbal(II) oksida.
Q: Berapakah bilangan oksidasi timbal?
A: Bilangan oksidasi timbal pada PbO adalah +2, dan pada PbO2 adalah +4.
T: Apakah PbO bersifat amfoter?
J: Tidak, PbO tidak bersifat amfoter; itu tidak menunjukkan sifat asam atau basa.
T: Apa itu PbO?
J: PbO adalah rumus kimia untuk timbal(II) oksida, senyawa yang digunakan dalam berbagai aplikasi termasuk baterai timbal-asam dan manufaktur kaca.
Q: Bagaimana cara menyetarakan persamaan Pb(NO3)2 = PbO + NO2 + O2?
A: Persamaan setara penguraian timbal(II) nitrat (Pb(NO3)2) adalah 2Pb(NO3)2 = 2PbO + 4NO2 + O2.
