Timbal klorida (PbCl2) adalah padatan kristal putih yang dibentuk dengan menggabungkan timbal dan klorin. Ini digunakan dalam berbagai aplikasi, termasuk pigmen, pewarna dan sebagai bahan baku dalam sintesis kimia.
| Nama IUPAC | Timbal(II) klorida |
| Formula molekul | PbCl2 |
| nomor CAS | 7758-95-4 |
| Sinonim | Timbal diklorida, timbal klorida, timbal (II) diklorida, timbal diklorida |
| Di ChI | InChI=1S/2ClH.Pb/h2*1H;/q;;+2/p-2 |
Sifat timbal klorida
Formula Timbal Klorida
Rumus timbal diklorida adalah PbCl2. Hal ini menunjukkan bahwa setiap unit timbal diklorida mengandung satu atom timbal (Pb) dan dua atom klor (Cl). Senyawa kristal putih ini terbentuk dari kombinasi atom timbal dan klor.
Massa Molar Timbal Klorida
Massa molar timbal diklorida kira-kira 278,1 g/mol. Nilai ini diperoleh dengan menjumlahkan massa atom satu atom timbal (207,2 g/mol) dan dua atom klor (2 * 35,5 g/mol).
Titik didih timbal klorida
Timbal diklorida memiliki titik didih sekitar 1.074 derajat Celcius (1.967 derajat Fahrenheit). Pada suhu ini, timbal diklorida padat berubah menjadi gas.
Titik leleh timbal klorida
Titik leleh timbal diklorida kira-kira 501 derajat Celcius (934 derajat Fahrenheit). Pada suhu ini, timbal diklorida padat berubah menjadi cair.
Massa jenis timbal klorida g/mL
Timbal diklorida memiliki kepadatan sekitar 5,85 g/mL. Nilai densitas ini menunjukkan massa timbal diklorida yang menempati satu mililiter volume.
Berat Molekul Timbal Klorida
Berat molekul timbal diklorida kira-kira 278,1 g/mol. Ini mewakili massa satu mol molekul timbal diklorida.
Struktur timbal klorida
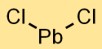
Timbal diklorida memiliki struktur kristal dimana ion timbal (Pb2+) dikelilingi oleh ion klorida (Cl-) dalam susunan kisi. Ikatan ionik ini berkontribusi terhadap stabilitas dan sifat-sifatnya.
Kelarutan timbal klorida
Timbal diklorida memiliki kelarutan terbatas dalam air. Ia larut dalam air membentuk larutan tidak berwarna dan kelarutannya dapat dipengaruhi oleh faktor-faktor seperti suhu dan keberadaan ion lain. Namun, timbal diklorida lebih larut dalam asam tertentu, seperti asam klorida.
Singkatnya, timbal diklorida (PbCl2) adalah senyawa kristal putih dengan massa molar sekitar 278,1 g/mol. Titik lelehnya sekitar 501 derajat Celcius dan titik didihnya sekitar 1.074 derajat Celcius. Dengan kepadatan 5,85 g/mL, timbal diklorida memiliki kelarutan terbatas dalam air dan membentuk struktur kristal yang berbeda karena ikatan ioniknya antara ion timbal dan klorida.
| Penampilan | Padatan putih |
| Berat jenis | 5,85 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 278,1 g/mol |
| Kepadatan | 5,85 gram/ml |
| Titik fusi | 501°C |
| Titik didih | 1074°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Membatasi |
| Kelarutan | Larut dalam beberapa asam, seperti asam klorida |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Harap dicatat bahwa beberapa sifat, seperti titik nyala, tekanan uap, kepadatan uap, pKa dan pH, tidak berlaku atau tidak tersedia untuk timbal diklorida.
Keamanan dan Bahaya Timbal Klorida
Timbal diklorida menimbulkan beberapa risiko keamanan. Ini beracun jika tertelan, terhirup atau terserap melalui kulit sehingga menimbulkan risiko kesehatan, terutama bagi anak-anak dan ibu hamil. Penanganan timbal diklorida memerlukan peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata pengaman, untuk mencegah kontak dengan kulit dan mata. Selain itu, sebaiknya digunakan di area yang berventilasi baik untuk menghindari penghirupan uap beracun. Penyimpanan dan penanganan yang hati-hati sangat penting untuk menghindari tumpahan dan kontaminasi. Jika terjadi paparan yang tidak disengaja, perhatian medis segera diperlukan. Karena toksisitasnya, mengikuti tindakan pencegahan keselamatan dan membuang timbal diklorida dengan benar sangat penting untuk melindungi kesehatan manusia dan lingkungan.
| Simbol bahaya | Bahaya, Beracun |
| Deskripsi Keamanan | Beracun; Berbahaya jika tertelan, terhirup atau terserap melalui kulit. Gunakan dengan hati-hati. |
| Nomor identifikasi PBB | T/A (timah diklorida tidak mendapat nomor PBB) |
| kode HS | 2827399000 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | III (Kelompok Pengepakan III – Bahan yang mempunyai bahaya kecil) |
| Toksisitas | Sangat beracun; menimbulkan risiko kesehatan, terutama pada anak-anak dan wanita hamil. Gunakan langkah-langkah keamanan yang tepat. |
Harap dicatat bahwa timbal diklorida tidak diberi nomor khusus PBB karena tidak diangkut dalam jumlah besar, namun termasuk dalam kelas bahaya zat beracun (6.1). Tindakan pencegahan keselamatan yang tepat harus diambil saat menangani dan menggunakan timbal diklorida karena toksisitasnya.
Metode sintesis timbal klorida
Berbagai metode ada untuk mensintesis timbal diklorida. Pendekatan yang umum dilakukan adalah dengan memanaskan logam timbal dan melewatkan gas klor melaluinya, sehingga menghasilkan pembentukan timbal diklorida. Metode lain melibatkan mereaksikan timbal oksida (PbO) dengan asam klorida (HCl) untuk menghasilkan timbal diklorida dan air.
Rute lain mencakup metode pengendapan, di mana garam timbal yang larut bereaksi dengan garam klorida yang larut seperti natrium klorida (NaCl) , menghasilkan timbal diklorida sebagai endapan padat. Dalam reaksi perpindahan ganda, timbal diklorida terbentuk ketika timbal nitrat (Pb(NO3)2) bereaksi dengan garam klorida yang larut seperti natrium klorida . Reaksi tersebut menghasilkan timbal diklorida dan natrium nitrat (NaNO3).
Untuk menjamin keselamatan pihak-pihak yang terlibat dan meminimalkan dampak terhadap lingkungan, penting untuk mengikuti tindakan pencegahan keselamatan yang tepat selama proses sintesis. Hal ini termasuk menggunakan ventilasi yang memadai dan memakai peralatan pelindung yang sesuai karena toksisitas timbal diklorida.
Kegunaan timbal klorida
Timbal diklorida memiliki beberapa kegunaan di berbagai industri. Berikut beberapa penerapannya:
- Pigmen: Timbal diklorida memberikan kecerahan dan opasitas, menjadikannya pigmen putih yang digunakan dalam cat, pelapis, dan pewarna.
- Sintesis Kimia: Ini memainkan peran penting sebagai bahan mentah dalam proses sintesis kimia, khususnya dalam produksi senyawa timbal dan bahan kimia lainnya.
- Penstabil PVC: Timbal diklorida meningkatkan stabilitas termal dan kinerja keseluruhan polivinil klorida (PVC) sebagai penstabil selama produksi.
- Reagen Laboratorium: Laboratorium menggunakan timbal diklorida sebagai reagen aktif untuk pengujian dan analisis kimia tertentu.
- Mordan dalam Pencelupan: Secara aktif berfungsi sebagai mordan dalam proses pewarnaan, memfasilitasi pengikatan pewarna pada tekstil dan kain.
- Aplikasi nuklir: Timbal diklorida secara efektif melindungi radiasi di reaktor dan fasilitas nuklir karena kepadatannya yang tinggi dan kemampuannya menyerap sinar gamma.
- Pelapisan listrik: Dalam aplikasi pelapisan listrik, timbal diklorida secara aktif mengendapkan lapisan tipis timbal pada berbagai permukaan logam, meningkatkan ketahanan terhadap korosi dan konduktivitas.
- Baterai: Timbal diklorida memainkan peran penting dalam beberapa jenis baterai timbal-asam, berkontribusi terhadap kimia baterai.
Meskipun timbal diklorida memiliki berbagai kegunaan, sifat toksiknya memerlukan penanganan yang hati-hati dan pembuangan yang tepat untuk mencegah bahaya kesehatan dan lingkungan.
Pertanyaan:
Q: Berapa mol PbCl2 yang akan terbentuk?
J: Jumlah mol yang terbentuk bergantung pada jumlah reaktan tertentu dan persamaan kimia seimbang.
Q: Apakah PbCl2 larut dalam air?
A: PbCl2 memiliki kelarutan terbatas dalam air.
Q: Berapa mol PbCl2?
A: Jumlah mol PbCl2 dapat ditentukan dengan menggunakan massa dan massa molarnya.
Q: Manakah dari berikut ini yang tidak larut dalam air? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
Jawaban: PbCl2 tidak larut dalam air.
Q: Apakah PbCl2 merupakan endapan?
A: Ya, jika ion Pb2+ dan Cl- bereaksi membentuk padatan, maka itu adalah endapan.
Q: Berapa mol timbal klorida yang akan terbentuk?
A: Jumlah mol yang terbentuk bergantung pada stoikiometri reaksi.
T: Apakah timbal klorida larut dalam air?
J: Timbal diklorida memiliki kelarutan terbatas dalam air.
Q: Berapa banyak satuan rumus dalam 500,0 g timbal(II) klorida?
A: Jumlah satuan rumus dapat dihitung menggunakan massa molar dan konstanta Avogadro.
Q: Bagaimana timbal(II) klorida bereaksi dalam air panas?
J: Timbal(II) diklorida sebagian dapat larut dalam air panas karena kelarutannya meningkat seiring suhu.
Q: Berapa gram dalam 8,32 mol timbal(II) klorida?
A: Massa dapat ditentukan dengan menggunakan massa molar timbal(II) diklorida dan jumlah mol yang diketahui.
T: Apakah timbal klorida dapat larut?
J: Timbal diklorida memiliki kelarutan terbatas dalam air.
T: Manakah dari reaksi berikut yang akan mengubah reaksi ini menjadi timbal klorida padat?
J: Menghilangkan ion Cl- dari campuran reaksi akan menggesernya ke arah pembentukan timbal diklorida padat.
T: Apa rumus timbal(IV) diklorida?
J: Rumus timbal(IV) diklorida adalah PbCl4.
Q: Kelarutan timbal(II) diklorida (PbCl2) adalah 1,6 × 10^-2 M. Berapa Ksp PbCl2?
A: Ksp (konstanta hasil kali kelarutan) PbCl2 dapat dihitung dari kelarutannya.
