Karbon tetraklorida adalah cairan tidak berwarna dengan bau manis. Ini umumnya digunakan sebagai pelarut, namun produksi dan penggunaannya telah menurun karena dampaknya yang berbahaya bagi kesehatan dan lingkungan.
| Nama IUPAC | Tetraklorometana |
| Formula molekul | CCl4 |
| nomor CAS | 56-23-5 |
| Sinonim | Karbon tet, Tetraform, Perklorometana, Tetrasol |
| Di ChI | InChI=1S/CCl4/c2-1(3,4)5 |
Sifat karbon tetraklorida
Rumus karbon tetraklorida
Rumus kimia karbon tetraklorida adalah CCl4. Ini mewakili molekul yang terdiri dari atom karbon yang terikat pada empat atom klor. Rumusnya memberikan informasi penting tentang komposisi unsur dan susunan atom dalam senyawa.
Massa Molar Karbon Tetraklorida
Massa molar tetraklorometana dihitung dengan menjumlahkan massa atom unsur penyusunnya. Karbon memiliki massa molar 12,01 g/mol, sedangkan klorin memiliki massa molar 35,45 g/mol. Jika dijumlahkan, massa molar tetraklorometana kira-kira 153,82 g/mol.
Titik didih karbon tetraklorida
Tetraklorometana memiliki titik didih yang relatif tinggi yaitu 76,72°C (170,1°F). Artinya pada tekanan atmosfer standar, senyawa berubah dari cair menjadi gas pada suhu tersebut. Titik didih mencerminkan kekuatan gaya antarmolekul dalam suatu zat.
Karbon tetraklorida Titik lebur
Titik leleh tetraklorometana adalah -22,92°C (-9,26°F). Ini adalah suhu di mana bentuk padat suatu senyawa berubah menjadi cair. Titik leleh memberikan gambaran tentang kekuatan ikatan yang menyatukan atom-atom dalam kisi kristal.
Massa jenis karbon tetraklorida g/mL
Kepadatan tetraklorometana kira-kira 1,586 g/mL. Massa jenis mengacu pada massa suatu zat per satuan volume. Massa jenis tetraklorometana menunjukkan massa jenisnya lebih padat dibandingkan air yang mempunyai massa jenis 1 g/mL.
Berat Molekul Karbon Tetraklorida
Berat molekul tetraklorometana dihitung dengan menjumlahkan berat atom atom penyusunnya. Dengan satu atom karbon (12,01 g/mol) dan empat atom klor (masing-masing 35,45 g/mol), berat molekul tetraklorometana kira-kira 153,82 g/mol.
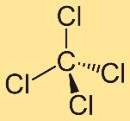
Struktur karbon tetraklorida
Struktur tetraklorometana terdiri dari atom karbon pusat yang terikat pada empat atom klor. Atom klor ini diposisikan secara simetris di sekitar atom karbon, membentuk geometri tetrahedral. Struktur ini berkontribusi terhadap sifat dan perilaku senyawa.
Kelarutan karbon tetraklorida
Tetraklorometana sulit larut dalam air, dengan kelarutan sekitar 0,8 g/L pada 20°C. Namun, ia menunjukkan kelarutan yang lebih tinggi dalam pelarut organik seperti etanol, eter dan benzena. Karakteristik kelarutan dipengaruhi oleh gaya antarmolekul dan polaritas zat yang terlibat.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1.586 |
| Warna | T/A |
| Bau | Lembut |
| Masa molar | 153,82 g/mol |
| Kepadatan | 1,586 gram/mL |
| Titik fusi | -22,92°C (-9,26°F) |
| Titik didih | 76,72°C (170,1°F) |
| Titik kilat | T/A |
| Kelarutan dalam air | 0,8 g/L pada 20°C |
| Kelarutan | Larut dalam pelarut organik seperti etanol, eter dan benzena |
| Tekanan uap | 11,9 mmHg pada 20°C |
| Kepadatan uap | 5.3 (udara = 1) |
| pKa | T/A |
| pH | T/A |
Keamanan dan bahaya karbon tetraklorida
Tetraklorometana menimbulkan risiko keamanan yang signifikan. Ini dianggap sangat beracun dan dapat membahayakan kesehatan manusia. Menghirup uapnya dapat menyebabkan iritasi pernafasan, pusing, mual bahkan kerusakan hati dan ginjal. Kontak kulit dengan cairan dapat menyebabkan luka bakar dan iritasi. Senyawa ini juga dikenal sebagai karsinogen, sehingga menimbulkan risiko kesehatan jangka panjang. Selain itu, tetraklorometana berbahaya bagi lingkungan karena berpotensi mencemari tanah dan air. Karena bahaya ini, produksi dan penggunaannya telah dibatasi secara signifikan untuk meminimalkan paparan dan melindungi kesehatan manusia dan lingkungan. Protokol penanganan, penyimpanan dan pembuangan yang tepat harus diikuti untuk mengurangi risiko yang terkait dengan tetraklorometana.
| Simbol bahaya | T, Xn |
| Deskripsi Keamanan | Sangat beracun; Berbahaya |
| Nomor identifikasi PBB | Sebuah tahun 1846 |
| kode HS | 2903.14.0000 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II |
| Toksisitas | Toksisitas akut, Karsinogenik |
Metode sintesis karbon tetraklorida
Tetraklorometana dapat disintesis dengan metode yang berbeda. Metode yang umum melibatkan reaksi antara gas klor (Cl2) dan karbon disulfida (CS2) dengan adanya katalis seperti aluminium klorida (AlCl3).
Dalam proses ini, gas klor bereaksi dengan uap karbon disulfida menghasilkan tetraklorometana dan belerang. Reaksi berlangsung sebagai berikut:
Cl2 + CS2 → CCl4 + S
Metode lain melibatkan reaksi antara metana (CH4) dan gas klor. Dalam kondisi terkendali, metana bereaksi dengan klorin dengan adanya sinar ultraviolet (UV) atau panas menghasilkan tetraklorometana dan hidrogen klorida. Reaksi berlangsung sebagai berikut:
CH4 + 4Cl2 → CCl4 + 4HCl
Klorinasi karbon disulfida menggunakan hidrogen klorida (HCl) sebagai zat klorinasi menghasilkan tetraklorometana. Reaksi ini memerlukan katalis, seperti besi(III) klorida (FeCl3). Reaksi berlangsung sebagai berikut:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Saat mensintesis tetraklorometana, individu harus berhati-hati karena sifat senyawa yang berbahaya. Mereka harus menerapkan langkah-langkah keamanan yang ketat dan peralatan yang sesuai untuk memastikan kesejahteraan mereka dan mencegah pencemaran lingkungan.
Kegunaan karbon tetraklorida
Berbagai aplikasi telah memanfaatkan sifat unik tetraklorometana. Berikut beberapa kegunaannya:
- Pelarut: Tetraklorometana setelah melarutkan minyak, gemuk, karet dan lilin, berfungsi sebagai pelarut. Namun, toksisitas dan masalah lingkungan telah mengurangi penggunaan pelarut secara signifikan.
- Alat Pemadam Api: Tetraklorometana digunakan untuk memadamkan jenis kebakaran tertentu yang melibatkan peralatan listrik dan cairan yang mudah terbakar. Alternatif yang lebih aman dan dampak berbahayanya telah menyebabkan penghentian penggunaannya secara bertahap.
- Bahan antara kimia: Tetraklorometana telah berfungsi sebagai zat antara kimia dalam produksi berbagai senyawa, seperti zat pendingin, pestisida, dan obat-obatan.
- Bahan pembersih: Industri sebelumnya menggunakan tetraklorometana sebagai bahan pembersih permukaan logam dan komponen elektronik. Namun, risiko kesehatan dan lingkungan telah mendorong kita memilih alternatif yang lebih aman.
- Reagen laboratorium: Tetraklorometana terkadang digunakan sebagai reagen atau pelarut untuk reaksi dan ekstraksi tertentu di laboratorium. Ahli kimia umumnya lebih memilih alternatif yang lebih aman dan membatasi penggunaannya.
Penting untuk dicatat bahwa banyak dari penerapan ini telah menurun, atau bahkan berhenti sama sekali, karena efek berbahaya dari tetraklorometana terhadap kesehatan manusia dan lingkungan. Akibatnya, penggunaan tetraklorometana telah menurun secara signifikan dan zat-zat alternatif yang tidak terlalu beracun dan berdampak buruk terhadap lingkungan telah diadopsi di berbagai industri.
Pertanyaan:
T: Apakah Anda masih bisa membeli pengganti karbon tetraklorida?
J: Ya, ada pengganti tetraklorometana yang lebih aman dan memiliki dampak lingkungan yang lebih rendah.
T: Apakah Anda masih bisa membeli karbon tetraklorida?
J: Tetraklorometana dibatasi di banyak negara karena toksisitasnya dan risiko terhadap lingkungan, sehingga ketersediaannya untuk dibeli terbatas.
T: Apakah karbon tetraklorida legal?
J: Tetraklorometana tunduk pada pembatasan hukum di banyak negara karena dampak buruknya terhadap kesehatan dan lingkungan.
T: Apakah karbon tetraklorida bersifat basa atau asam?
J: Tetraklorometana tidak bersifat basa atau asam; itu adalah senyawa netral.
T: Apakah karbon tetraklorida bersifat polar atau non-polar?
J: Tetraklorometana adalah molekul non-polar karena struktur tetrahedralnya yang simetris, sehingga menghasilkan pembagian elektron yang sama.
Q: Berapa massa molar karbon tetraklorida?
J: Massa molar tetraklorometana kira-kira 153,82 g/mol.
T: Apa itu karbon tetraklorida?
J: Tetraklorometana adalah senyawa cair tidak berwarna yang dahulu digunakan sebagai pelarut, namun penggunaannya sekarang terbatas karena toksisitasnya dan masalah lingkungan.
T: Apa rumus kimia karbon tetraklorida?
A: Rumus kimia tetraklorometana adalah CCl4.
Q: Apakah ikatannya ada pada karbon tetraklorida?
J: Ikatan dalam tetraklorometana bersifat kovalen, dengan empat ikatan kovalen antara atom karbon pusat dan atom klor di sekitarnya.
T: Apakah karbon tetraklorida bersifat ionik atau kovalen?
J: Tetraklorometana adalah senyawa kovalen karena membentuk ikatan dengan berbagi elektron antara atom karbon dan klor.
T: Berapa banyak atom klor dalam molekul karbon tetraklorida?
J: Ada empat atom klor dalam molekul tetraklorometana.
T: Untuk setiap zat terlarut, tentukan pelarut terbaik: air atau karbon tetraklorida?
J: Pelarut terbaik bergantung pada zat terlarutnya. Air umumnya merupakan pelarut yang lebih baik untuk zat-zat polar, sedangkan tetraklorometana lebih baik untuk zat-zat non-polar.
Q: Struktur Lewis tetraklorometana?
J: Dalam struktur Lewis tetraklorometana, atom karbon pusat terikat pada empat atom klor, tanpa pasangan elektron bebas pada atom karbon pusat.
