Boron oksida (B2O3) adalah senyawa yang dibentuk oleh ikatan kimia boron dan oksigen. Ini digunakan dalam produksi kaca dan keramik karena titik lelehnya yang tinggi.
| Nama IUPAC | Boron oksida |
| Formula molekul | B2O3 |
| nomor CAS | 1303-86-2 |
| Sinonim | Triboron trioksida, borat oksida, boron(III) oksida |
| Di ChI | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Sifat boron oksida
Rumus Boron Oksida
Rumus kimia borat oksida adalah B2O3. Ini mewakili rasio atom boron terhadap atom oksigen dalam senyawa. Angka indeks menunjukkan bahwa terdapat dua atom boron dan tiga atom oksigen dalam setiap molekul oksida borat.
Massa Molar Boron Oksida
Massa molar oksida borat dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Boron memiliki massa atom 10,81 g/mol, sedangkan oksigen memiliki massa atom 16,00 g/mol. Dengan mengalikan massa atom dengan jumlah atom masing-masing dan menjumlahkannya, massa molar oksida borat ditentukan menjadi 69,62 g/mol.
Titik didih boron oksida
Borat oksida memiliki titik didih yang tinggi sekitar 1.860 derajat Celcius. Artinya, pada tekanan atmosfer normal, diperlukan energi yang signifikan untuk mengubah oksida borat dari wujud cair menjadi gas.
Titik lebur boron oksida
Titik leleh oksida borat sekitar 450 derajat Celcius. Pada suhu ini, oksida borat padat berubah menjadi cair. Titik lelehnya yang relatif rendah membuatnya cocok untuk berbagai aplikasi industri.
Massa jenis boron oksida g/mL
Oksida borat memiliki kepadatan sekitar 2,46 g/mL. Massa jenis mengacu pada massa per satuan volume suatu zat. Kepadatan oksida borat menunjukkan bahwa ia relatif padat, sehingga memungkinkannya mengalir di sebagian besar cairan.
Berat molekul boron oksida
Berat molekul oksida borat, juga disebut massa molar, adalah 69,62 g/mol. Nilai ini mewakili massa satu mol senyawa dan berguna untuk menghitung jumlah oksida borat dalam sampel tertentu.
Struktur boron oksida
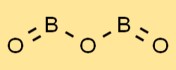
Oksida borat memiliki struktur yang unik, menampilkan susunan unit BO3 trigonal planar. Atom boron dikelilingi oleh tiga atom oksigen yang tersusun segitiga. Susunan ini memberikan oksida borat sifat dan stabilitas yang khas.
Kelarutan boron oksida
Borat oksida tidak larut dalam air dan sebagian besar pelarut organik. Kelarutannya terbatas dalam asam seperti asam sulfat dan asam klorida. Kelarutan yang rendah ini berkontribusi terhadap stabilitas dan kegunaannya dalam berbagai aplikasi, seperti produksi kaca dan keramik.
| Penampilan | Padatan putih |
| Berat jenis | 2,46 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 69,62 g/mol |
| Kepadatan | 2,46 gram/ml |
| Titik fusi | 450°C |
| Titik didih | 1860°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Kelarutan terbatas dalam asam, seperti asam sulfat dan asam klorida |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Harap dicatat bahwa beberapa sifat seperti titik nyala, tekanan uap, kepadatan uap, pKa dan pH tidak berlaku atau belum dilaporkan untuk oksida borat.
Keamanan dan bahaya boron oksida
Oksida borat menimbulkan pertimbangan keamanan dan bahaya tertentu. Kontak langsung dengan bubuk atau debu oksida borat dapat mengiritasi kulit, mata, dan sistem pernapasan. Penting untuk menanganinya dengan hati-hati dan menggunakan alat pelindung diri yang sesuai seperti sarung tangan dan kacamata. Menghirup partikel oksida borat dapat menyebabkan iritasi pernafasan, jadi disarankan untuk bekerja di tempat yang berventilasi baik. Jika tertelan secara tidak sengaja, perhatian medis harus segera dicari. Borat oksida tidak mudah terbakar dan tidak memiliki titik nyala. Seperti halnya bahan kimia lainnya, pedoman penanganan dan penyimpanan yang tepat disarankan untuk diikuti untuk memastikan penggunaan yang aman.
| Simbol bahaya | Tidak diklasifikasikan |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata. Gunakan di area yang berventilasi baik. Kenakan peralatan pelindung. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2810.00.2000 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah hingga sedang. Dapat menyebabkan iritasi jika terkena atau terhirup. |
Harap dicatat bahwa oksida borat tidak membawa simbol bahaya, identifikasi PBB, kelas bahaya atau kelompok pengepakan. Penting untuk mengikuti pedoman dan praktik keselamatan umum saat menangani dan menggunakan oksida borat untuk meminimalkan risiko paparan dan memastikan penggunaan yang aman.
Metode sintesis boron oksida
Berbagai metode memungkinkan sintesis oksida borat. Pendekatan yang banyak digunakan adalah dengan memanaskan unsur boron dengan adanya oksigen atau udara untuk menghasilkan oksida borat. Metode lain melibatkan mereaksikan boron halida, seperti boron triklorida (BCl3) atau boron tribromida (BBr3), dengan air, menghasilkan pembentukan oksida borat.
Selain itu, senyawa yang mengandung boron seperti boron nitrida atau boron trisulfida dapat mengalami hidrolisis dengan air untuk menghasilkan oksida borat. Dekomposisi termal borat, seperti natrium borat atau boraks , bila terkena panas juga menghasilkan oksida borat.
Penting untuk dicatat bahwa pilihan metode sintesis tertentu bergantung pada kemurnian, kuantitas, dan penerapan oksida borat yang diinginkan. Setiap metode memiliki kelebihan dan mungkin cocok untuk situasi yang berbeda.
Kegunaan boron oksida
Borat oksida menemukan berbagai aplikasi di berbagai industri. Berikut beberapa kegunaannya:
- Produksi kaca dan keramik: Oksida borat merupakan bahan utama dalam pembuatan kaca dan keramik. Ini memberi produk kaca sifat yang diinginkan seperti tahan panas, transparan, dan tahan lama.
- Penghambat Api: Produsen menggunakan oksida borat sebagai penghambat api pada bahan seperti tekstil, plastik, dan produk kayu. Oksida borat mengurangi sifat mudah terbakar bahan-bahan ini, sehingga meningkatkan keamanan.
- Kaca Borosilikat: Oksida borat memainkan peran penting sebagai komponen kaca borosilikat, yang dikenal dengan ekspansi termal rendah dan ketahanan panas tinggi. Industri menggunakan kaca jenis ini pada peralatan laboratorium, peralatan dapur, dan perangkat optik kelas atas.
- Serat khusus: Produksi serat khusus, termasuk serat boron dan serat boron nitrida, menggunakan penggunaan oksida borat. Serat ini memiliki sifat mekanik dan termal yang luar biasa, sehingga cocok untuk industri dirgantara, otomotif, dan teknologi tinggi.
- Bahan Kimia Boron: Oksida borat berfungsi sebagai prekursor untuk sintesis berbagai bahan kimia boron, seperti borat dan boron hidrida. Bahan kimia ini dapat diterapkan di bidang pertanian, farmasi, dan sistem penyimpanan energi.
- Fluks dan Agen Penyolderan: Oksida borat mengurangi titik leleh bahan dan meningkatkan fluiditasnya, menjadikannya fluks yang efektif dalam proses metalurgi. Ini meningkatkan ikatan permukaan logam saat digunakan sebagai bahan solder.
- Katalis: Reaksi kimia mendapat manfaat dari katalis oksida borat karena katalis tersebut mendorong reaksi yang diinginkan dan meningkatkan laju reaksi.
- Industri Semikonduktor: Oksida borat memainkan peran penting dalam produksi semikonduktor. Ia bertindak sebagai bahan doping untuk secara aktif mengubah sifat listrik silikon.
Beragamnya penerapan oksida borat menyoroti keserbagunaan dan pentingnya borat dalam berbagai industri, sehingga berkontribusi terhadap kemajuan teknologi, keselamatan, dan ilmu material.
Pertanyaan:
Q: Berapakah bilangan oksidasi boron dalam B2O3?
J: Bilangan oksidasi boron dalam B2O3 adalah +3.
Q: Apa rumus empiris boron oksida?
A: Rumus empiris oksida borat adalah B2O3.
T: Kapan konsentrasi boron di permukaan akan mempengaruhi laju pertumbuhan oksida?
A: Konsentrasi boron di permukaan akan mempengaruhi laju pertumbuhan oksida ketika ia bertindak sebagai dopan atau katalis dalam proses oksidasi.
T: Apa itu Boria Boron Oksida?
A: Borat oksida, juga dikenal sebagai boria, adalah senyawa dengan rumus kimia B2O3.
Q: Berapakah bilangan oksidasi boron?
J: Boron umumnya memiliki bilangan oksidasi +3.
T: Akankah boron memperlambat oksidasi pada bahan yang kekurangan oksigen?
J: Boron tidak memperlambat oksidasi pada bahan yang kekurangan oksigen karena memerlukan oksigen untuk membentuk oksida borat.
Q: Berapakah bilangan oksidasi boron dalam HBO2 dalam CuO?
J: Bilangan oksidasi boron di HBO2 adalah +3.
Q: Berapa mol B2O3 yang dapat dibentuk?
A: Jumlah mol B2O3 yang terbentuk bergantung pada jumlah reaktan yang digunakan dalam reaksi.
T: Apakah B2O3 bersifat ionik atau molekuler?
J: B2O3 adalah senyawa ionik.
Q: Pasangan manakah yang diurutkan berdasarkan peningkatan kebasaan? PBO < SiO2 B2O3 < Li2O
A: Pasangan yang diurutkan berdasarkan kenaikan kebasaannya adalah B2O3 < Li2O < PBO < SiO2.
Q: B2H6 + O2 → B2O3 + H2O, apakah persamaan ini seimbang?
J: Tidak, persamaannya tidak seimbang. Hal ini memerlukan penyesuaian untuk mencapai persamaan yang seimbang.
T: Berapa banyak boron yang dapat Anda peroleh dari 210,0 pon B2O3?
J: Jumlah boron yang diperoleh dari 210,0 pon B2O3 bergantung pada massa molar dan stoikiometri reaksi.
