Amonium bikarbonat adalah senyawa kristal putih yang digunakan dalam pembuatan kue sebagai bahan pembentuk. Ini melepaskan karbon dioksida saat dipanaskan, menghasilkan makanan yang dipanggang ringan dan empuk.
| Nama IUPAC | Amonium bikarbonat |
| Formula molekul | NH4HCO3 |
| nomor CAS | 1066-33-7 |
| Sinonim | amonium karbonat asam; amonia roti; Garam amonium dari asam karbonat (1:1); Amonium hidrogen karbonat |
| Di ChI | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Harap dicatat bahwa nilai InChI yang diberikan adalah representasi yang disederhanakan dan mungkin tidak lengkap.
Sifat amonium bikarbonat
Rumus Amonium Bikarbonat
Rumus kimia amonium bikarbonat adalah NH4HCO3. Terdiri dari ion amonium (NH4+) dan ion bikarbonat (HCO3-). Rumus ini mewakili komposisi senyawa, yang menunjukkan adanya gugus amonium dan bikarbonat.
Massa Molar Amonium Bikarbonat
Massa molar amonium hidrogen karbonat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Untuk amonium hidrogen karbonat (NH4HCO3), massa molarnya kira-kira 79,06 gram per mol. Nilai ini penting untuk berbagai perhitungan dan konversi kimia.
Titik didih amonium bikarbonat
Amonium hidrogen karbonat tidak memiliki titik didih yang jelas karena terurai menjadi produk gas saat dipanaskan. Namun proses penguraian dimulai sekitar 60 hingga 70 derajat Celcius. Ketika suhu meningkat, senyawa tersebut terurai menjadi amonia (NH3), air (H2O), dan karbon dioksida (CO2).
Titik Leleh Amonium Bikarbonat
Titik leleh amonium hidrogen karbonat kira-kira 41 hingga 60 derajat Celcius. Ketika dipanaskan, senyawa mengalami sublimasi, langsung berubah dari padat menjadi gas tanpa melalui fase cair.
Massa jenis amonium bikarbonat g/mL
Massa jenis amonium hidrogen karbonat kira-kira 1,59 gram per mililiter (g/mL) pada suhu kamar. Nilai ini mewakili massa senyawa per satuan volume. Kepadatan amonium hidrogen karbonat mempengaruhi perilakunya dalam berbagai aplikasi dan kelarutannya dalam pelarut yang berbeda.
Berat Molekul Amonium Bikarbonat
Berat molekul amonium hidrogen karbonat kira-kira 79,06 gram per mol. Nilai ini diperoleh dengan menjumlahkan massa atom unsur-unsur yang ada dalam senyawa (nitrogen, hidrogen, karbon, dan oksigen). Berat molekul penting untuk menghitung jumlah amonium hidrogen karbonat yang dibutuhkan untuk reaksi kimia.
Struktur amonium bikarbonat
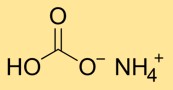
Amonium hidrogen karbonat memiliki struktur kristal yang tersusun dari ion amonium (NH4+) dan bikarbonat (HCO3-). Ion amonium dibentuk oleh kombinasi satu atom nitrogen dan empat atom hidrogen, sedangkan ion bikarbonat terdiri dari satu atom karbon yang terikat pada tiga atom oksigen.
Kelarutan amonium bikarbonat
Amonium hidrogen karbonat sangat larut dalam air. Ini mudah larut dalam larutan air, melepaskan ion amonium dan ion bikarbonat. Namun kelarutannya menurun seiring dengan kenaikan suhu. Ini sulit larut dalam alkohol dan tidak larut dalam sebagian besar pelarut organik.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 1,586 gram/cm³ |
| Warna | Tanpa warna |
| Bau | Bau amonia |
| Masa molar | 79,06 g/mol |
| Kepadatan | 1,59 gram/ml |
| Titik fusi | 41-60°C |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air; sukar larut dalam alkohol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | ~7 |
Harap dicatat bahwa nilai yang diberikan merupakan perkiraan dan dapat bervariasi tergantung pada faktor-faktor seperti kemurnian dan kondisi lingkungan.
Keamanan dan bahaya amonium bikarbonat
Amonium hidrogen karbonat menimbulkan pertimbangan keamanan dan bahaya tertentu. Ini dapat mengiritasi mata, kulit dan sistem pernapasan jika bersentuhan atau terhirup. Paparan langsung dapat menimbulkan ketidaknyamanan, termasuk sensasi terbakar. Penting untuk menangani senyawa tersebut dengan hati-hati dan menggunakan alat pelindung diri yang sesuai, seperti sarung tangan dan kacamata. Selain itu, amonium hidrogen karbonat dapat melepaskan gas amonia berbahaya saat dipanaskan, sehingga diperlukan ventilasi yang memadai dalam situasi seperti itu. Senyawa ini tidak mudah terbakar dan tidak memiliki titik nyala tertentu. Penyimpanan, pelabelan, dan kepatuhan terhadap protokol keselamatan yang tepat sangat penting untuk meminimalkan risiko yang terkait dengan penanganan dan penggunaan amonium hidrogen karbonat.
| Simbol bahaya | Xi (Menjengkelkan) |
| Deskripsi Keamanan | – Hindari kontak dengan mata, kulit, dan pernafasan.\n- Gunakan alat pelindung diri yang sesuai.\n- Pastikan ventilasi yang memadai saat menangani.\n- Simpan dengan benar dan beri label pada wadah.\n – Ikuti protokol keselamatan. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 28369990 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tidak diklasifikasikan |
| Toksisitas | Toksisitas rendah; mengiritasi mata, kulit dan sistem pernapasan. |
Harap dicatat bahwa informasi yang diberikan bersifat umum dan mungkin tidak mencakup semua aspek keamanan dan bahaya amonium hidrogen karbonat. Penting untuk mengacu pada lembar data keselamatan dan peraturan khusus untuk panduan lengkap.
Metode sintesis amonium bikarbonat
Ada beberapa metode untuk mensintesis amonium hidrogen karbonat.
Metode yang umum melibatkan reaksi antara gas amonia (NH3) dan karbon dioksida (CO2) dalam larutan air. Dalam proses ini, Anda menggelembungkan kedua gas langsung ke dalam air dan air membentuk larutan amonium hidrogen karbonat. Kemudian Anda memusatkan dan mengkristalkan larutan untuk mendapatkan senyawa padat.
Pendekatan lain adalah reaksi antara amonia dan karbon dioksida dalam pelarut, seperti metanol atau etanol. Reaksi berlangsung di bawah tekanan dan suhu tinggi, menghasilkan pembentukan kristal amonium hidrogen karbonat.
Perlakuan amonium karbonat dengan karbon dioksida menghasilkan amonium bikarbonat dan air. Amonium karbonat , baik dalam bentuk padat maupun larutan, bereaksi dengan karbon dioksida menghasilkan amonium bikarbonat.
Untuk mensintesis amonium hidrogen karbonat, amonia dapat dikombinasikan dengan asam karbonat. Asam karbonat dibentuk dengan melarutkan karbon dioksida dalam air, dan menambahkan amonia ke dalam larutan asam karbonat yang dihasilkan menghasilkan amonium hidrogen karbonat.
Pastikan sintesis amonium hidrogen karbonat berlangsung di area yang berventilasi baik karena pelepasan gas amonia selama reaksi. Ikuti tindakan pencegahan keselamatan dan protokol penanganan untuk memastikan proses sintesis yang aman dan efisien.
Kegunaan Amonium Bikarbonat
Amonium hidrogen karbonat memiliki berbagai kegunaan di berbagai industri dan aplikasi. Berikut adalah beberapa kegunaan umum:
- Memanggang: Amonium hidrogen karbonat digunakan sebagai bahan sisa dalam pembuatan kue, terutama untuk kue kering, kerupuk, dan makanan panggang lainnya. Ini melepaskan karbon dioksida saat dipanaskan, menciptakan tekstur yang ringan dan renyah.
- Produksi Amonia: Amonium hidrogen karbonat berfungsi sebagai senyawa perantara dalam produksi amonia. Ini dapat terurai menjadi amonia dan karbon dioksida, yang kemudian dapat dipisahkan dan digunakan untuk berbagai keperluan.
- Pertanian: Petani menggunakannya sebagai sumber nitrogen dalam pupuk untuk menyediakan nutrisi penting bagi pertumbuhan tanaman. Tanaman mudah menyerapnya karena kelarutannya dalam air.
- Kontrol pH: Industri menggunakan amonium hidrogen karbonat untuk menyesuaikan tingkat pH dalam proses seperti pengolahan air, pembuatan pewarna, dan produksi pigmen.
- Alat Pemadam Kebakaran: Beberapa alat pemadam api bubuk kering menggunakan senyawa ini sebagai alat pemadam api. Ini memadamkan api dan mengganggu proses pembakaran.
- Agen Pembersih: Beberapa industri menggunakannya sebagai bahan pembersih untuk menghilangkan kotoran, minyak dan kontaminan dari permukaan.
- Industri tekstil dan kulit: Dalam proses pewarnaan dan pencetakan tekstil dan barang-barang kulit, amonium hidrogen karbonat membantu memperbaiki pewarna dan meningkatkan tahan luntur warna.
- Aplikasi farmasi: Dapat diterapkan dalam formulasi farmasi tertentu sebagai zat penyangga atau bahan dalam tablet obat.
Beragam aplikasi amonium hidrogen karbonat menyoroti keserbagunaan dan kegunaannya di berbagai industri, termasuk pembuatan kue, pertanian, kontrol pH, pemadaman kebakaran, dan berbagai proses manufaktur.
Pertanyaan:
T: Apakah amonium bikarbonat buruk bagi Anda?
J: Amonium hidrogen karbonat mungkin berbahaya jika tertelan atau terhirup dalam jumlah banyak, menyebabkan iritasi pada sistem pernapasan dan kulit. Ini harus ditangani dan digunakan dengan tindakan pencegahan yang tepat.
T: Bagaimana cara memisahkan amonium karbonat dari amonium bikarbonat?
A: Amonium karbonat dapat dipisahkan dari amonium hidrogen karbonat dengan memanaskan campurannya, karena amonium bikarbonat terurai menjadi amonia, karbon dioksida, dan air, meninggalkan amonium karbonat.
Q: Bagaimana cara menghitung pH amonium bikarbonat dalam air?
A: pH amonium hidrogen karbonat dalam air dapat dihitung menggunakan persamaan Henderson-Hasselbalch: pH = pKa + log([A-]/[HA]), dengan pKa adalah konstanta disosiasi asam dan [A-]/[ HA] mewakili rasio basa konjugasi terhadap asam.
T: Bagaimana cara mengatur pH buffer amonium bikarbonat?
J: PH buffer amonium hidrogen karbonat dapat diatur dengan menambahkan asam kuat untuk menurunkan pH atau basa kuat untuk meningkatkan pH sambil mempertahankan rasio amonium bikarbonat yang sesuai dengan basa konjugasinya.
T: Apakah amonium bikarbonat aman untuk makanan?
J: Amonium hidrogen karbonat secara umum diakui aman (GRAS) untuk digunakan dalam makanan, namun harus digunakan sesuai dengan pedoman peraturan dan dalam jumlah yang tepat.
T: Apa yang dimaksud dengan buffer amonium bikarbonat?
A: Buffer amonium hidrogen karbonat adalah larutan yang mengandung amonium hidrogen karbonat dan basa konjugasinya (atau asam), yang digunakan untuk menjaga kestabilan pH dalam berbagai aplikasi biokimia dan biologi.
T: Berapa massa molekul amonium bikarbonat?
A: Massa molekul amonium hidrogen karbonat kira-kira 79,06 g/mol.
Q: Berapa persen komposisi hidrogen dalam NH4HCO3?
J: Komposisi persen massa hidrogen dalam NH4HCO3 kira-kira 6,57%.
Q: Apakah NH4HCO3 termasuk asam atau basa?
J: NH4HCO3 dapat bertindak sebagai asam dan basa, tergantung pada konteksnya. Ia dapat menyumbangkan proton (H+) untuk bertindak sebagai asam atau menerima proton untuk bertindak sebagai basa.
Q: Apa nama senyawa yang rumusnya NH4HCO3?
A: Senyawa dengan rumus NH4HCO3 disebut amonium hidrogenkarbonat.
Q: Apakah NH4HCO3 bersifat ionik atau kovalen?
J: NH4HCO3 dianggap senyawa ionik karena adanya ion amonium (NH4+) dan ion hidrogen karbonat (HCO3-) dalam strukturnya.
