Nikel(II) oksida adalah senyawa kimia dengan rumus NiO. Ini adalah padatan hitam, biasa digunakan sebagai katalis dan dalam produksi keramik dan pigmen.
| Nama IUPAC | Nikel(II) oksida |
| Formula molekul | NiO |
| nomor CAS | 1313-99-1 |
| Sinonim | Nikel oksida, nikel monoksida, Ni(II) oksida |
| Di ChI | InChI=1S/Ni.O |
Sifat nikel(II) oksida
Rumus Nikel(II) Oksida
Rumus kimia nikel monoksida adalah NiO. Ini terdiri dari satu atom nikel (Ni) dan satu atom oksigen (O), menghasilkan rumus yang sederhana dan mudah dipahami.
Nikel(II) Oksida Jisim Molar
Massa molar nikel monoksida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Untuk NiO, massa molarnya kira-kira 74,69 gram per mol (g/mol).
Titik didih nikel(II) oksida
Nikel monoksida tidak memiliki titik didih yang jelas karena mengalami penguraian sebelum mencapai titik didihnya. Ketika dipanaskan, ia terurai menjadi unsur-unsur penyusunnya, nikel dan oksigen.
Nikel(II) oksida Titik lebur
Titik leleh nikel monoksida kira-kira 1984 derajat Celsius (1984 °C). Pada suhu ini, NiO padat berubah menjadi cair.
Massa jenis nikel(II) oksida g/mL
Kepadatan nikel monoksida sekitar 6,67 gram per mililiter (g/mL). Nilai ini menunjukkan jumlah massa yang dikemas ke dalam volume tertentu, sehingga menjadi ukuran kekompakan suatu zat.
Berat Molekul Nikel(II) Oksida
Berat molekul nikel monoksida dihitung dengan menjumlahkan berat atom unsur penyusunnya. Untuk NiO, berat molekulnya kira-kira 74,69 gram per mol (g/mol).
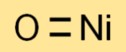
Struktur nikel(II) oksida
Nikel monoksida memiliki struktur kristal kubik. Terdiri dari ion nikel (Ni2+) dan ion oksida (O2-) yang tersusun dalam pola yang teratur dan berulang. Struktur ini berkontribusi terhadap sifat dan perilaku karakteristiknya.
Kelarutan nikel(II) oksida
Nikel monoksida sulit larut dalam air. Ia memiliki kelarutan terbatas, artinya hanya sedikit larut dalam air. Namun, ia dapat bereaksi dengan asam untuk membentuk garam nikel yang larut, dan menunjukkan tingkat reaktivitas kimia tertentu.
| Penampilan | Hitam pekat |
| Berat jenis | 6,67g/ml |
| Warna | Hitam |
| Bau | Tidak berbau |
| Masa molar | 74,69 g/mol |
| Kepadatan | 6,67g/ml |
| Titik fusi | 1984°C |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Larut dalam asam, membentuk garam nikel larut |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | Netral |
Harap diperhatikan bahwa beberapa sifat, seperti titik nyala, tekanan uap, dan pKa, tidak berlaku atau tersedia untuk nikel monoksida.
Keamanan dan Bahaya Nikel(ii) Oksida
Nikel monoksida menimbulkan pertimbangan dan bahaya keamanan tertentu. Penting untuk menanganinya dengan hati-hati. Kontak langsung dengan kulit, mata, atau menghirup debu atau uapnya harus dihindari. Hal ini dapat menyebabkan iritasi kulit dan reaksi alergi pada beberapa orang. Jika tertelan atau terhirup, perhatian medis segera diperlukan. Nikel monoksida tidak dianggap sangat mudah terbakar namun dapat menyebabkan kebakaran jika terkena bahan yang mudah terbakar. Penting untuk menyimpan dan menanganinya di tempat yang berventilasi baik. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kaca mata, harus dipakai saat bekerja dengan nikel monoksida untuk meminimalkan potensi risiko.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tangani dengan hati-hati. Hindari kontak langsung dan penghirupan. Gunakan peralatan pelindung yang sesuai. Dapatkan pertolongan medis jika perlu. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2825.70.10 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tidak diklasifikasikan |
| Toksisitas | Dianggap berbahaya jika tertelan atau terhirup. Dapat menyebabkan iritasi kulit dan reaksi alergi. |
Harap diperhatikan bahwa nikel monoksida tidak membawa simbol bahaya tertentu, pengenal PBB, kelas bahaya, atau kelompok pengepakan. Informasi keselamatan yang diberikan didasarkan pada pengetahuan umum dan tindakan pencegahan terkait penanganan dan penggunaan nikel monoksida. Penting untuk mengacu pada lembar data keselamatan (SDS) tertentu dan mengikuti praktik keselamatan yang direkomendasikan untuk mendapatkan informasi yang akurat dan terperinci.
Metode sintesis nikel(ii) oksida
Ada beberapa metode untuk mensintesis nikel monoksida. Pendekatan yang umum dilakukan adalah dekomposisi termal senyawa nikel, seperti nikel karbonat atau nikel hidroksida. Dalam metode ini, memanaskan senyawa prekursor tertentu tanpa adanya oksigen membentuk nikel monoksida.
Metode lain melibatkan oksidasi logam nikel. Nikel logam dapat bereaksi dengan oksigen atau udara pada suhu tinggi menghasilkan nikel monoksida. Proses ini dilakukan dengan cara mengkalsinasi atau memanggang logam nikel dalam atmosfer udara atau oksigen sehingga menghasilkan nikel monoksida.
Gunakan reaksi pengendapan untuk mensintesis nikel monoksida dengan mereaksikan garam nikel, seperti nikel klorida atau nikel nitrat, dengan larutan basa seperti natrium hidroksida atau amonium hidroksida . Reaksi ini membentuk endapan nikel monoksida.
Sintesis sol-gel adalah metode lain yang layak. Hal ini melibatkan hidrolisis dan kondensasi prekursor nikel yang sesuai, seperti nikel alkoksida, dalam suatu larutan. Nikel monoksida diperoleh dengan mengeringkan dan mengkalsinasi gel yang terbentuk selama reaksi pengendapan.
Gunakan teknik elektrodeposisi untuk sintesis nikel monoksida. Dengan mengalirkan arus listrik ke elektroda nikel yang direndam dalam larutan elektrolit, nikel monoksida dapat terbentuk di permukaan elektroda.
Ketika memilih metode sintesis, faktor-faktor seperti kemurnian yang diinginkan, skalabilitas, dan persyaratan aplikasi spesifik harus dipertimbangkan, karena masing-masing metode menawarkan kelebihannya sendiri.
Kegunaan Nikel(ii) Oksida
Nikel monoksida memiliki berbagai kegunaan di berbagai industri karena sifatnya yang unik. Berikut beberapa penerapan umumnya:
- Katalis: Nikel monoksida secara aktif mengkatalisis berbagai reaksi kimia, seperti proses hidrogenasi dan oksidasi, memfasilitasi konversi reaktan menjadi produk yang diinginkan.
- Keramik: Dalam produksi bahan keramik, nikel monoksida secara aktif berfungsi sebagai zat pewarna, secara aktif berkontribusi untuk mencapai warna dan pola tertentu pada glasir dan pigmen keramik.
- Baterai: Baterai nikel-kadmium (NiCd) dan nikel-metal hidrida (NiMH) yang dapat diisi ulang secara aktif menggunakan nikel monoksida sebagai bahan elektroda positif, sehingga secara aktif memungkinkan penyimpanan dan pelepasan energi listrik.
- Sensor gas: Nikel monoksida secara aktif mendeteksi gas seperti karbon monoksida (CO) dan nitrogen dioksida (NO2) dalam aplikasi deteksi gas ketika digunakan dalam sensor berdasarkan gas tersebut.
- Manufaktur Kaca: Industri kaca secara aktif menggunakan nikel monoksida untuk memberikan berbagai warna pada produk kaca, sehingga secara aktif berkontribusi pada produksi kaca berwarna, termasuk corak hijau, coklat dan hitam.
- Pelapis Konduktif: Nikel monoksida secara aktif berfungsi sebagai komponen dalam pelapis konduktif, yang membuat bahan seperti kaca atau plastik menjadi konduktif aktif saat diaplikasikan padanya.
- Sel Bahan Bakar: Nikel monoksida aktif berfungsi sebagai komponen sel bahan bakar oksida padat (SOFC), aktif bertindak sebagai bahan katoda dan berpartisipasi dalam reaksi elektrokimia di dalam sel bahan bakar.
- Dukungan Katalis: Nikel monoksida secara aktif berfungsi sebagai bahan pendukung untuk katalis lain, secara aktif meningkatkan stabilitas dan kinerjanya.
Beragamnya penerapan nikel monoksida menyoroti pentingnya nikel dalam berbagai industri, menyoroti kegunaan dan keserbagunaannya.
Pertanyaan:
Q: Apa rumus nikel(II) oksida?
J: Rumus nikel(II) oksida adalah NiO.
Q: Garam apa yang terbentuk ketika nikel(II) oksida bereaksi dengan asam nitrat?
A: Reaksi nikel(II) oksida dengan asam nitrat membentuk nikel(II) nitrat (Ni(NO3)2).
T: Pada tegangan berapa nikel(II) teroksidasi menjadi nikel(III)?
A: Nikel(II) teroksidasi menjadi nikel(III) pada tegangan sekitar +1,63V.
Q: Apa yang terjadi jika Ni(s) dioksidasi menjadi ion nikel(II), seperti terlihat pada gambar?
A: Selama oksidasi Ni(s) menjadi ion nikel(II), elektron hilang, sehingga terbentuk ion Ni2+.
Q: Berapa massa nikel(II) oksida dan aluminium yang harus digunakan untuk menghasilkan 13,3 g nikel?
A: Massa nikel(II) oksida dan aluminium yang dibutuhkan untuk menghasilkan 13,3 g nikel bergantung pada reaksi spesifik dan stoikiometri yang terlibat.
