Sulfuril klorida (SO2Cl2) adalah senyawa yang dibentuk oleh kombinasi sulfur dioksida dan klorin. Ini digunakan sebagai reagen dalam reaksi kimia dan sebagai fumigan untuk mengendalikan hama.
| Nama IUPAC | Sulfuril klorida |
| Formula molekul | SO2Cl2 |
| nomor CAS | 7791-25-5 |
| Sinonim | Sulfur diklorida, Sulfur oksiklorida, Sulfur diklorida oksida |
| Di ChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Sifat sulfuril klorida
Formula Sulfuril Klorida
Rumus kimia sulfur diklorida adalah SO2Cl2. Itu berasal dari kombinasi satu atom belerang, dua atom oksigen dan dua atom klor. Rumus ini mewakili komposisi dan susunan atom dalam molekul sulfur diklorida.
Jisim Molar Sulfuril Klorida
Massa molar sulfur diklorida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Sulfur diklorida memiliki massa molar sekitar 134,97 gram per mol. Nilai ini penting untuk berbagai perhitungan reaksi kimia dan stoikiometri.
Titik didih sulfuril klorida
Sulfur diklorida memiliki titik didih kurang lebih 69 derajat Celcius. Ketika suhu naik di atas titik ini, sulfur diklorida mengalami perubahan fasa, berubah dari cair menjadi gas. Titik didih merupakan parameter penting dalam menentukan kondisi di mana sulfur diklorida dapat digunakan atau ditangani.
Titik Leleh Sulfuril Klorida
Titik leleh sulfur diklorida kira-kira -54 derajat Celcius. Pada suhu di bawah titik ini, sulfur diklorida berubah dari wujud padat menjadi cair. Titik leleh penting untuk penyimpanan dan penanganan sulfur diklorida karena menunjukkan kondisi di mana ia membeku atau mencair.
Massa jenis sulfuril klorida g/mL
Massa jenis sulfur diklorida kira-kira 1,638 gram per mililiter (g/mL). Massa jenis mewakili massa suatu zat per satuan volume dan membantu menentukan perilaku fisiknya. Kepadatan sulfur diklorida penting untuk memahami daya apung, kelarutan, dan kompatibilitasnya dengan zat lain.
Berat Molekul Sulfuril Klorida
Berat molekul sulfur diklorida kira-kira 134,97 satuan massa atom (u). Ini adalah jumlah massa atom atom penyusun molekul sulfur diklorida. Berat molekul memberikan informasi penting untuk berbagai perhitungan kimia dan untuk menentukan jumlah zat dalam sampel tertentu.
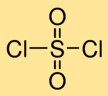
Struktur sulfuril klorida
Sulfur diklorida memiliki struktur molekul dimana satu atom belerang berikatan ganda dengan dua atom oksigen dan berikatan tunggal dengan dua atom klor. Susunan ini membentuk atom belerang pusat yang dikelilingi oleh atom oksigen dan klor, sehingga memberikan struktur karakteristik belerang diklorida.
Kelarutan sulfuril klorida
Sulfur diklorida sulit larut dalam air. Bereaksi dengan air menghasilkan asam klorida dan asam sulfat, menjadikannya reaktif secara hidrolitik. Namun, sulfur diklorida menunjukkan beberapa kelarutan dalam pelarut organik seperti hidrokarbon terklorinasi dan senyawa aromatik, sehingga cocok untuk aplikasi tertentu.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,638 gram/mL |
| Warna | T/A |
| Bau | Pedas, menyesakkan |
| Masa molar | 134,97 g/mol |
| Kepadatan | 1,638 gram/mL |
| Titik fusi | -54°C |
| Titik didih | 69°C |
| Titik kilat | T/A |
| Kelarutan dalam air | Bereaksi dengan penuh semangat |
| Kelarutan | Larut dalam pelarut organik seperti hidrokarbon terklorinasi dan senyawa aromatik |
| Tekanan uap | 43,6 mmHg (pada 25°C) |
| Kepadatan uap | 4,43 (udara = 1) |
| pKa | T/A |
| pH | T/A |
Keamanan dan Bahaya Sulfuril Klorida
Sulfur diklorida menimbulkan beberapa bahaya keselamatan dan tindakan pencegahan harus diambil saat menanganinya. Ini adalah zat korosif yang dapat menyebabkan luka bakar parah pada kulit, mata, dan saluran pernapasan jika bersentuhan. Menghirup langsung uapnya dapat menyebabkan iritasi pernafasan dan kerusakan paru-paru. Ia bereaksi hebat dengan air, melepaskan gas beracun dan menimbulkan risiko ledakan. Oleh karena itu, penting untuk menangani sulfur diklorida di area yang berventilasi baik dan mengenakan peralatan pelindung yang sesuai, seperti sarung tangan, kacamata, dan pelindung pernapasan. Tumpahan harus segera dibersihkan menggunakan prosedur yang sesuai dan disimpan di tempat sejuk dan kering, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Korosif (C), Pengoksidasi (O) |
| Deskripsi Keamanan | Menyebabkan luka bakar kulit yang parah dan kerusakan mata. Bereaksi hebat dengan air. |
| Nomor identifikasi PBB | PBB 1834 (Sulfur diklorida) |
| kode HS | 28121000 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II (Bahaya sedang) |
| Toksisitas | Sangat beracun; Berbahaya jika tertelan, terhirup atau terserap melalui kulit. |
Metode sintesis sulfuril klorida
Orang biasanya menggunakan beberapa metode untuk mensintesis sulfur diklorida.
Salah satu metode melibatkan reaksi antara sulfur dioksida (SO2) dan gas klor (Cl2) . Dengan adanya katalis, seperti karbon aktif atau aluminium klorida, gas bereaksi membentuk sulfur diklorida (SO2Cl2). Reaksi ini umumnya terjadi pada suhu tinggi, sekitar 100 hingga 200°C.
Metode lain untuk mensintesis sulfur diklorida melibatkan reaksi sulfur trioksida (SO3) dengan hidrogen klorida (HCl). Dalam kondisi terkendali, kedua senyawa ini bergabung menghasilkan sulfur diklorida. Reaksi ini bersifat eksotermik dan umumnya terjadi pada fasa gas.
Proses tionil klorida menghasilkan sulfur diklorida melalui reaksi asam sulfat (H2SO4) dengan fosfor pentaklorida (PCl5) pada suhu kamar. Reaksi ini menghasilkan sulfur diklorida serta produk samping seperti asam fosfat (H3PO4) dan hidrogen klorida (HCl). Lingkungan industri umumnya menggunakan metode ini.
Penting untuk dicatat bahwa metode sintesis ini memerlukan penanganan reagen yang hati-hati dan pertimbangan tindakan pencegahan keselamatan karena reaktivitas dan sifat berbahaya dari zat yang terlibat.
Selain itu, ahli kimia sering menggunakan peralatan yang sesuai, seperti kondensor dan sistem refluks, untuk mengontrol kondisi reaksi dan memastikan keberhasilan sintesis sulfur diklorida.
Kegunaan Sulfuril Klorida
Sulfur diklorida (SO2Cl2) dapat digunakan dalam berbagai industri karena sifatnya yang unik. Berikut adalah beberapa kegunaan utama sulfur diklorida:
- Reagen Kimia: Sintesis organik biasanya menggunakan sulfur diklorida sebagai reagen kimia serbaguna, yang secara aktif berpartisipasi dalam berbagai reaksi termasuk klorinasi, sulfonasi, dan esterifikasi, memungkinkan masuknya fungsi klorin, sulfur, atau asam ke dalam senyawa organik.
- Pestisida dan Fumigan: Sulfur diklorida bertindak sebagai fumigan yang ampuh untuk mengendalikan hama pada penyimpanan biji-bijian, pabrik tepung dan fasilitas pengolahan makanan, secara aktif menghilangkan serangga, larva dan hama yang dapat merusak produk pertanian yang disimpan karena sifat biosidalnya yang kuat.
- Polimerisasi: Dalam polimerisasi monomer tertentu, seperti vinil klorida, sulfur diklorida berfungsi sebagai katalis aktif atau inisiator, memfasilitasi produksi polivinil klorida (PVC), polimer termoplastik yang banyak digunakan dengan aplikasi dalam industri konstruksi, otomotif, dan listrik.
- Obat-obatan: Sulfur diklorida secara aktif memainkan peran penting dalam sintesis senyawa farmasi, terutama sulfonamid, yang merupakan antibiotik penting dan agen terapeutik yang digunakan untuk mengobati berbagai infeksi.
- Industri pewarna: Sulfur diklorida berperan aktif dalam produksi pewarna, khususnya yang mengandung sulfur atau klorin. Ini secara aktif memperkenalkan gugus fungsi yang diinginkan dan meningkatkan ketahanan luntur warna dan stabilitas pewarna.
- Zat antara kimia: Sulfur diklorida berfungsi sebagai zat antara aktif dalam sintesis bahan kimia lainnya, termasuk sulfur dioksida, asam sulfat, dan sulfonil klorida, yang dapat diterapkan di banyak industri seperti produksi deterjen, manufaktur plastik, dan obat-obatan.
- Pengolahan Air: Untuk pemurnian dan desinfeksi air, sulfur diklorida secara aktif menetralkan dan menghilangkan bakteri berbahaya, virus, dan mikroorganisme lain yang ada di sumber air.
- Aplikasi laboratorium: Berbagai prosedur laboratorium secara aktif menggunakan sulfur diklorida, misalnya untuk deteksi dan penentuan amina primer dan sekunder. Ia aktif bereaksi dengan amina untuk membentuk sulfonamid yang stabil, memfasilitasi analisis dan karakterisasinya.
Pertanyaan:
Q: Berapa jumlah gram molekul SO2Cl2 dalam 13,5 g sulfuril klorida?
A: Jumlah gram molekul SO2Cl2 dalam 13,5 g sulfuril klorida dapat dihitung dengan membagi massa tertentu dengan massa molar SO2Cl2.
Q: Apakah SO2Cl2 bersifat polar atau non-polar?
J: SO2Cl2 adalah molekul polar karena adanya ikatan polar dan geometri molekul asimetris.
Q: Kapan tekanan SO2Cl2 akan berkurang?
A: Penurunan tekanan SO2Cl2 bergantung pada berbagai faktor seperti suhu, volume dan kondisi reaksi. Hal ini tidak dapat ditentukan berdasarkan waktu saja.
Q: Berapa tekanan parsial SO2Cl2 dalam campuran ini?
A: Tekanan parsial SO2Cl2 dalam suatu campuran dapat ditentukan dengan menggunakan hukum gas ideal, bergantung pada suhu, volume, dan fraksi mol atau konsentrasi SO2Cl2.
Q: Jenis gaya antarmolekul apa yang diharapkan terjadi antara molekul SO2Cl2?
A: Gaya antarmolekul yang diharapkan antara molekul SO2Cl2 mencakup interaksi dipol-dipol dan gaya dispersi London.
Q: Pada titik manakah tekanan parsial SO2Cl2 akan turun hingga sepersepuluh dari nilai awalnya?
J: Waktu yang diperlukan agar tekanan parsial SO2Cl2 turun hingga sepersepuluh dari nilai awalnya bergantung pada kondisi spesifik sistem dan laju reaksi kimia yang terlibat.
Q: Berapa massa molar SO2Cl2?
A: Massa molar SO2Cl2 kira-kira 134,97 gram per mol.
Q: Apa geometri molekul SO2Cl2?
A: Geometri molekul SO2Cl2 berbentuk melengkung atau berbentuk V, dengan atom belerang di tengahnya terikat pada dua atom oksigen dan dua atom klor.
Q: Bagaimana struktur Lewis SO2Cl2?
A: Struktur Lewis SO2Cl2 terdiri dari atom belerang yang terikat rangkap pada atom oksigen dan ikatan tunggal dengan atom oksigen lain, dengan dua atom klor yang terikat pada atom belerang.
