Tionil klorida adalah senyawa kimia yang digunakan dalam berbagai aplikasi industri. Bereaksi dengan alkohol dan asam karboksilat, masing-masing menghasilkan klorida dan sulfuril klorida.
| Nama IUPAC | Tionil klorida |
| Formula molekul | SOCl₂ |
| nomor CAS | 7719-09-7 |
| Sinonim | Sulfur diklorida, Sulfur oksiklorida, Tionil diklorida |
| Di ChI | InChI=1S/Cl2OS/c1-4(2)3 |
Sifat-sifat tionil klorida
Rumus Tionil Klorida
Rumus tionil diklorida adalah SOCl₂, mewakili satu atom belerang yang terikat pada dua atom klor. Ini adalah senyawa kimia yang banyak digunakan di berbagai industri.
Massa Molar Tionil Klorida
Tionil diklorida memiliki massa molar sekitar 118,97 gram per mol. Massa molar ditentukan dengan menjumlahkan massa atom unsur-unsur penyusunnya.
Titik didih tionil klorida
Tionil diklorida memiliki titik didih kurang lebih 79,6 derajat Celcius. Ini adalah suhu di mana bentuk cair tionil diklorida berubah menjadi gas.
Titik leleh tionil klorida
Titik leleh tionil diklorida kira-kira -104,5 derajat Celcius. Ini adalah suhu di mana bentuk padat tionil diklorida berubah menjadi cair.
Massa jenis tionil klorida g/mL
Tionil diklorida memiliki kepadatan sekitar 1,64 gram per mililiter. Massa jenis adalah ukuran massa per satuan volume dan merupakan karakteristik penting suatu zat.
Berat Molekul Tionil Klorida
Berat molekul tionil diklorida kira-kira 118,97 gram per mol. Ini dihitung dengan menambahkan berat atom belerang, klor dan oksigen.
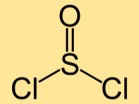
Struktur tionil klorida
Struktur tionil diklorida terdiri dari atom belerang yang terikat pada dua atom klor. Atom belerang dan klor tersusun linier membentuk molekul berbentuk melengkung.
Kelarutan tionil klorida
Tionil diklorida sulit larut dalam air tetapi mudah larut dalam pelarut organik seperti benzena, toluena, dan karbon tetraklorida. Kelarutannya merupakan faktor penting dalam penerapannya.
| Penampilan | Cairan tidak berwarna sampai kuning pucat |
| Berat jenis | 1,638 gram/mL |
| Warna | Tanpa warna |
| Bau | Pedas, menyesakkan |
| Masa molar | 118,97 g/mol |
| Kepadatan | 1,638 gram/mL |
| Titik fusi | -104,5°C |
| Titik didih | 79,6°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan keras |
| Kelarutan | Larut dalam pelarut organik seperti benzena, toluena dan karbon tetraklorida |
| Tekanan uap | 4,33 kPa pada 20°C |
| Kepadatan uap | 3,9 (udara = 1) |
| pKa | -6.3 |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya tionil klorida
Tionil diklorida menimbulkan beberapa risiko keselamatan dan harus ditangani dengan hati-hati. Bahan ini sangat korosif dan dapat menyebabkan luka bakar parah jika terkena kulit, mata, atau selaput lendir. Menghirup uapnya dapat menyebabkan iritasi dan kerusakan pernafasan. Senyawa tersebut bereaksi hebat dengan air, melepaskan gas beracun, seperti hidrogen klorida. Oleh karena itu harus disimpan dan ditangani jauh dari sumber kelembapan. Tionil diklorida juga bereaksi keras dengan alkohol dan senyawa yang mengandung air, sehingga dapat menimbulkan bahaya kebakaran atau ledakan. Ventilasi yang memadai, peralatan pelindung diri, dan praktik penyimpanan yang tepat sangat penting untuk memastikan penanganan tionil diklorida yang aman.
| Simbol bahaya | Korosif (C), Beracun (T), Berbahaya bagi Lingkungan (N) |
| Deskripsi Keamanan | – Jauhkan dari sumber kelembapan dan zat yang tidak kompatibel.<br>- Gunakan di area yang berventilasi baik dan kenakan alat pelindung diri yang sesuai.<br>- Tangani dengan hati-hati untuk menghindari kontak dengan kulit, mata, dan selaput lendir.<br> – Simpan dalam wadah tertutup rapat di tempat sejuk dan kering. |
| Nomor identifikasi PBB | PBB No. 1836 (Thionil diklorida) |
| kode HS | 2812.10.00 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II (Cukup berbahaya) |
| Toksisitas | Sangat beracun jika terhirup, tertelan, dan terserap oleh kulit.<br>- Dapat menyebabkan luka bakar parah dan iritasi saluran pernafasan.<br>- Dapat menyebabkan efek berbahaya jangka panjang pada organisme air. |
Metode sintesis tionil klorida
Metode yang berbeda memungkinkan sintesis tionil diklorida.
Pendekatan umum melibatkan reaksi antara sulfur trioksida (SO₃) dan sulfur diklorida (SCl₂) dengan adanya katalis seperti karbon aktif atau aluminium klorida . Reaksi berlangsung pada suhu tinggi, biasanya sekitar 300 hingga 400 °C, dan menghasilkan tionil diklorida.
Metode lain melibatkan reaksi langsung sulfur dioksida (SO₂) dengan fosfor pentaklorida (PCl₅) atau fosfor oksiklorida (POCl₃). Reaksi ini terjadi pada refluks, dengan penambahan reagen secara progresif, dan menghasilkan tionil diklorida.
Reaksi belerang dengan fosfor triklorida (PCl₃) menghasilkan tionil diklorida. Proses ini melibatkan pemanasan reaktan dan memungkinkan pembentukan tionil diklorida.
Metode lain melibatkan reaksi antara fosfor pentasulfida (P₂S₅) dan fosfor pentaklorida (PCl₅) dengan adanya katalis asam Lewis seperti aluminium klorida. Reaksi terjadi pada suhu tinggi dan menghasilkan pembentukan tionil diklorida.
Penting untuk dicatat bahwa metode sintesis ini memerlukan penanganan yang tepat dan tindakan pencegahan keselamatan karena sifat berbahaya dari reagen yang terlibat. Sintesis tionil diklorida yang aman dan efisien memerlukan keahlian ahli kimia berpengalaman dan penggunaan peralatan laboratorium yang sesuai.
Kegunaan Tionil Klorida
Tionil diklorida banyak digunakan di berbagai industri karena sifat kimianya yang serbaguna. Berikut beberapa kegunaan umum tionil diklorida:
- Konversi Asam Karboksilat: Tionil diklorida mengubah asam karboksilat menjadi asil klorida, sebagian besar menggunakan reaksi Vilsmeier-Haack dalam sintesis organik.
- Klorinasi alkohol: Tionil diklorida bereaksi dengan alkohol, membentuk alkil klorida dan digunakan dalam produksi senyawa terklorinasi untuk obat-obatan dan bahan kimia pertanian, yang dikenal sebagai reaksi Darzens.
- Agen dehidrasi: Tionil diklorida bertindak sebagai agen dehidrasi, memfasilitasi penghilangan berbagai senyawa dari air. Ini biasanya digunakan dalam sintesis pewarna, parfum dan zat antara farmasi.
- Pembuatan baterai litium-ion: Produsen menggunakan tionil diklorida untuk memproduksi baterai litium-tionil diklorida, yang memiliki kepadatan energi tinggi dan umur simpan yang lama. Baterai ini dapat digunakan pada perangkat medis, peralatan militer, dan sensor jarak jauh.
- Reaksi polimerisasi: Tionil diklorida berpartisipasi dalam reaksi polimerisasi, berkontribusi pada sintesis berbagai polimer, termasuk polikarbonat dan polianhidrida.
- Senyawa Fosfor: Tionil diklorida bereaksi dengan senyawa fosfor, seperti fosfor triklorida, menghasilkan fosforil klorida. Ahli kimia menggunakan zat antara ini untuk mensintesis senyawa organofosfat dan penghambat api.
- Reagen Kimia: Tionil diklorida berfungsi sebagai reagen serbaguna dalam banyak transformasi kimia, termasuk esterifikasi, halogenasi, dan reaksi substitusi nukleofilik.
Pertanyaan:
T: Dengan apa Anda membilas tionil klorida?
J: Tionil diklorida dapat dibilas dengan alkohol berlebih atau basa kompatibel, seperti larutan metanol atau natrium bikarbonat.
Q: Apa produk asam valerat dengan tionil klorida?
A: Reaksi asam valerat dengan tionil diklorida menghasilkan valeril klorida, serta gas sulfur dioksida.
T: Dapatkah Anda menambahkan tionil klorida dengan asam karboksilat?
J: Ya, tionil diklorida dapat ditambahkan ke asam karboksilat untuk mengubahnya menjadi asil klorida melalui reaksi Vilsmeier-Haack.
Q: Manakah rumus Lewis yang benar untuk tionil klorida (SOCl2) berikut ini?
A: Rumus Lewis yang benar untuk tionil diklorida (SOCl2) dinyatakan dengan S=O | Kl – Kl.
T: Apa yang mendorong reaksi tionil klorida?
A: Reaksi tionil diklorida didorong oleh tingginya reaktivitas tionil klorida, yang bertindak sebagai elektrofil dalam berbagai transformasi kimia.
T: Bagaimana cara memadamkan tionil klorida?
J: Tionil diklorida dapat dipadamkan dengan menambahkan bahan pemadam yang sesuai seperti alkohol primer atau sekunder, atau dengan menghidrolisisnya secara hati-hati dengan air.
T: Apa yang didapat jika Anda mencampurkan amina dengan tionil klorida?
J: Pencampuran amina dengan tionil diklorida menghasilkan pembentukan garam amina hidroklorida yang sesuai.
T: Apa itu tionil klorida?
A: Tionil diklorida adalah senyawa kimia dengan rumus SOCl2, biasa digunakan sebagai reagen dalam sintesis organik dan sebagai zat dehidrasi.
T: Apa pengaruh kelebihan tionil klorida?
J: Tionil diklorida yang berlebihan dapat menyebabkan reaksi hebat, yang mungkin menghasilkan gas beracun atau bahaya ledakan, dan harus ditangani dengan hati-hati.
Q: Bagaimana cara menetralkan tionil klorida?
J: Tionil diklorida dapat dinetralkan dengan menambahkannya secara hati-hati ke dalam basa yang sesuai dalam jumlah besar, seperti natrium bikarbonat atau natrium hidroksida, sambil memastikan tindakan pencegahan keselamatan yang tepat.
