Fosfor pentaklorida adalah senyawa kimia dengan rumus PCl5. Ini digunakan sebagai reagen dalam berbagai reaksi kimia. Ia bereaksi kuat dengan air, melepaskan gas hidrogen klorida.
| Nama IUPAC | Fosfor pentaklorida |
| Formula molekul | PCl5 |
| nomor CAS | 10026-13-8 |
| Sinonim | Pentaklorofosforan, fosfor (V) klorida, fosfor klorida, fosfor (V) klorida |
| Di ChI | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Sifat fosfor pentaklorida
Rumus Fosfor Pentaklorida
Rumus fosfor pentaklorida adalah PCl5. Ini terdiri dari satu atom fosfor yang terikat pada lima atom klor. Rumusnya mewakili rasio atom dalam senyawa.
Massa Molar Fosfor Pentaklorida
Massa molar fosfor(V) klorida dihitung dengan menjumlahkan massa atom semua unsur penyusunnya. Fosfor memiliki massa molar sekitar 30,97 gram per mol dan setiap atom klor memiliki massa molar sekitar 35,45 gram per mol. Penambahannya menghasilkan massa molar sekitar 208,24 gram per mol untuk fosfor (V) klorida.
Titik didih fosfor pentaklorida
Fosfor(V) klorida memiliki titik didih kurang lebih 167,8 derajat Celcius. Pada suhu tersebut, senyawa mengalami perubahan fasa dari cair menjadi gas. Titik didih dipengaruhi oleh gaya antarmolekul yang ada dalam senyawa.
Titik lebur fosfor pentaklorida
Titik leleh fosfor(V) klorida kira-kira -93,6 derajat Celcius. Ini adalah suhu di mana senyawa berubah dari padat menjadi cair. Titik leleh merupakan sifat penting dalam menentukan perilaku fisik suatu senyawa.
Massa jenis fosfor pentaklorida g/mL
Kepadatan fosfor(V) klorida kira-kira 2,1 gram per mililiter. Massa jenis menyatakan massa suatu zat per satuan volume. Kepadatan fosfor (V) klorida membantu untuk memahami susunannya dan kekompakan partikelnya.
Berat Molekul Fosfor Pentaklorida
Berat molekul fosfor(V) klorida kira-kira 208,24 gram per mol. Ini adalah jumlah berat atom dari semua atom yang ada dalam senyawa. Berat molekul berguna dalam berbagai perhitungan, seperti menentukan jumlah suatu zat dalam suatu massa atau volume tertentu.
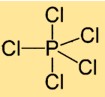
Struktur fosfor pentaklorida
Fosfor(V) klorida memiliki struktur molekul dimana satu atom fosfor dikelilingi oleh lima atom klor. Atom klor tersusun secara simetris di sekitar atom fosfor pusat, membentuk geometri trigonal bipiramida.
Kelarutan fosfor pentaklorida
Fosfor (V) klorida sulit larut dalam air. Ia bereaksi kuat dengan air, melepaskan gas hidrogen klorida. Namun, ia mudah larut dalam pelarut polar seperti benzena dan karbon tetraklorida. Kelarutan fosfor(V) klorida dipengaruhi oleh polaritas dan sifat kimia pelarut.
| Penampilan | Kristal tidak berwarna |
| Berat jenis | 2.1g/ml |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 208,24 g/mol |
| Kepadatan | 2.1g/ml |
| Titik fusi | -93,6°C |
| Titik didih | 167,8°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan penuh semangat |
| Kelarutan | Larut dalam pelarut polar seperti benzena dan karbon tetraklorida |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya fosfor pentaklorida
Fosfor(V) klorida menimbulkan beberapa risiko keselamatan. Bahan ini bersifat korosif dan dapat menyebabkan luka bakar parah pada kulit, mata, dan sistem pernapasan jika bersentuhan. Menghirup asap atau debunya dapat menyebabkan iritasi dan kerusakan pernafasan. Senyawa tersebut bereaksi hebat dengan air, melepaskan gas hidrogen klorida beracun. Ia juga sangat reaktif dengan bahan organik, berpotensi menyebabkan kebakaran atau ledakan. Tindakan pencegahan yang tepat harus diambil saat menangani fosfor(V) klorida, termasuk penggunaan peralatan pelindung seperti sarung tangan, kacamata, dan alat bantu pernapasan. Ini harus disimpan dan ditangani di tempat yang berventilasi baik, jauh dari bahan yang tidak kompatibel, untuk mencegah kecelakaan dan meminimalkan risiko.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Tangani dengan deposit. Gunakan peralatan pelindung yang sesuai. |
| Nomor identifikasi PBB | UN1806 |
| kode HS | 2812.20.00 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II (Bahaya sedang) |
| Toksisitas | Beracun jika tertelan atau terhirup. Dapat menyebabkan iritasi serius. |
Metode sintesis fosfor pentaklorida
Berbagai metode memungkinkan sintesis fosfor (V) klorida. Metode yang umum melibatkan reaksi antara fosfor triklorida (PCl3) dan gas klor (Cl2) . Dalam proses ini, bejana reaksi menggabungkan senyawa dan panas atau katalis seperti besi untuk memulai reaksi. Gas klorin bertindak sebagai oksidator, mengubah PCl3 menjadi PCl5. Reaksi berlangsung sebagai berikut:
PCl3 + Cl2 → PCl5
Metode lain untuk mensintesis fosfor(V) klorida melibatkan reaksi antara fosfor dan gas klor . Metode ini lebih langsung dan melibatkan reaksi berikut:
P4 + 10Cl2 → 4PCl5
Dalam reaksi ini, fosfor dan gas klor bereaksi pada kondisi tertentu, menghasilkan pembentukan fosfor(V) klorida.
Penting untuk dicatat bahwa kedua metode sintesis memerlukan penanganan yang hati-hati dan tindakan pencegahan keselamatan yang tepat. Reaksi melibatkan zat yang sangat reaktif dan korosif, sehingga diperlukan peralatan pelindung dan ventilasi yang memadai. Selain itu, penting untuk melakukan reaksi-reaksi ini di lingkungan yang terkendali untuk mencegah kecelakaan dan menjamin keselamatan personel yang terlibat.
Kegunaan fosfor pentaklorida
Fosfor(V) klorida mempunyai berbagai kegunaan karena sifat dan reaktivitasnya yang unik. Berikut beberapa kegunaannya:
- Sintesis kimia: Sintesis organik banyak menggunakan fosfor(V) klorida sebagai reagen untuk mengubah asam karboksilat menjadi asam klorida dan alkohol menjadi alkil klorida.
- Farmasi: Sintesis senyawa farmasi, termasuk antibiotik dan pewarna, sangat bergantung pada fosfor(V) klorida sebagai zat antara utama.
- Katalis: Fosfor(V) klorida mengkatalisis beberapa reaksi kimia, seperti asilasi Friedel-Crafts dan penataan ulang Beckmann.
- Industri polimer: Produksi berbagai polimer, termasuk polivinil klorida (PVC) dan polikarbonat, menggunakan fosfor(V) klorida sebagai bahan klorinasi.
- Aplikasi Laboratorium: Dalam aplikasi laboratorium, fosfor(V) klorida bertindak sebagai zat pengering untuk menghilangkan sisa air dari peralatan laboratorium dan sebagai zat klorinasi dan dehidrasi dalam berbagai reaksi.
- Herbisida dan Pestisida: Produksi herbisida dan pestisida untuk mengendalikan pertumbuhan gulma dan membasmi hama melibatkan penggunaan fosfor (V) klorida.
- Agen Peperangan Kimia: Secara historis, fosfor(V) klorida secara aktif berkontribusi pada produksi agen perang kimia, namun penggunaannya untuk tujuan tersebut kini tunduk pada peraturan dan pembatasan yang ketat.
- Perawatan Permukaan Logam: Proses perawatan permukaan logam menggunakan fosfor (V) klorida untuk meningkatkan sifat adhesi dan meningkatkan ketahanan terhadap korosi.
- Penghambat Api: Produksi bahan aditif tahan api untuk tekstil, plastik, dan bahan lainnya menggunakan fosfor(V) klorida.
- Manufaktur Farmasi: Fosfor(V) klorida digunakan dalam produksi berbagai produk farmasi, termasuk sintesis vitamin dan turunan hormon.
Penting untuk menangani fosfor(V) klorida dengan hati-hati dan mengikuti protokol keselamatan yang tepat karena sifatnya yang korosif dan potensi risiko kesehatan.
Pertanyaan:
T: Apa rumus fosfor pentaklorida yang benar?
A: Rumus fosfor(V) klorida yang benar adalah PCl5.
T: Apa rumus molekul fosfor pentaklorida?
A: Rumus molekul fosfor(V) klorida adalah PCl5.
Q: Berapa massa fosfor pentaklorida yang akan dihasilkan dari reaksi lengkap 15,2 g P4?
J: Massa fosfor (V) klorida yang dihasilkan kira-kira 208,24 g.
T: Apa bentuk fosfor pentaklorida?
A: Bentuk fosfor (V) klorida adalah trigonal bipiramidal.
Q: Berapa massa molekul fosfor pentaklorida?
A: Massa molekul fosfor(V) klorida kira-kira 208,24 gram per mol.
T: Sifat fosfor pentaklorida?
A: Fosfor(V) klorida bersifat korosif, bereaksi hebat dengan air, dan digunakan sebagai reagen dalam sintesis kimia.
Q: Sudut ikatan fosfor(V) klorida?
A: Sudut ikatan fosfor pentaklorida kira-kira 120 derajat (antara atom klor ekuator) dan 90 derajat (antara atom klor aksial).
T: Bagaimana cara membuat fosfor pentaklorida?
A: Fosfor (V) klorida dapat dibuat dengan mereaksikan fosfor triklorida (PCl3) dengan gas klor (Cl2) atau dengan reaksi langsung antara fosfor dan gas klor.
T: Apa geometri elektronik fosfor dalam fosfor pentaklorida?
A: Geometri elektronik fosfor dalam fosfor (V) klorida adalah trigonal bipyramidal.
