2 Butanon, juga dikenal sebagai metil etil keton atau MEK, adalah cairan tidak berwarna dan mudah terbakar dengan bau buah yang manis. Ini umumnya digunakan sebagai pelarut dalam berbagai aplikasi industri dan rumah tangga.
| Nama IUPAC | 2-Butanon |
| Formula molekul | C4H8O |
| nomor CAS | 78-93-3 |
| Sinonim | Metil etil keton (MEK), butan-2-one, 2-butanone, 3-oxobutan-2-one |
| Di ChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
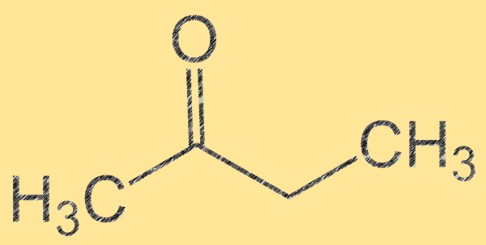
Struktur butanon
Butanon memiliki rumus molekul C4H8O dan struktur molekulnya dapat direpresentasikan sebagai CH3C(O)CH2CH3. Ini adalah cairan tidak berwarna dan mudah terbakar dengan bau buah yang manis. Butanon adalah keton, artinya mengandung gugus karbonil (C=O) yang terikat pada atom karbon. Gugus karbonil ini menjadikan butanon sebagai zat antara yang penting dalam sintesis berbagai senyawa organik.
Massa Molar 2-Butanon
Butanon, juga dikenal sebagai metil etil keton (MEK), memiliki massa molar 72,11 g/mol. Ini adalah jumlah zat dalam sampel butanon tertentu, dinyatakan dalam gram per mol. Massa molar merupakan sifat penting butanon yang digunakan dalam berbagai perhitungan dan eksperimen kimia, misalnya untuk menentukan massa suatu zat yang diperlukan untuk bereaksi dengan zat lain dalam perbandingan molar tertentu. Massa molar butanon juga dapat digunakan untuk mengubah massanya menjadi mol, yang berguna dalam banyak aplikasi termasuk reaksi kimia, sintesis kimia, dan kimia analitik.
Titik didih MEK
Titik didih MEK adalah 80,6°C (176,5°F). Ini adalah suhu di mana MEK berubah dari cair menjadi gas. Titik didih merupakan sifat penting MEK karena mempengaruhi kemampuannya menguap dan membentuk uap. Misalnya, dalam beberapa aplikasi MEK digunakan sebagai pelarut dan diinginkan agar MEK cepat menguap sehingga zat terlarut dapat dihilangkan. Dalam aplikasi lain, MEK diinginkan untuk tetap dalam bentuk cairnya, sehingga dapat digunakan sebagai pelarut untuk reaksi yang dilakukan pada atau di bawah titik didihnya.
Titik lebur MEK
Titik leleh MEK adalah -93,9°C (-136,0°F). Ini adalah suhu di mana MEK berubah dari padat menjadi cair. Titik lebur merupakan sifat penting MEK karena mempengaruhi kemampuannya untuk digunakan sebagai pelarut zat padat. Misalnya, MEK dapat digunakan sebagai pelarut padatan tertentu yang titik lelehnya lebih rendah dari titik lelehnya, seperti lemak, lilin, dan resin.
Kepadatan MEK g/mL
Kepadatan MEK adalah 0,80 g/mL. Ini adalah massa per satuan volume MEK dan merupakan properti penting yang digunakan dalam banyak aplikasi, termasuk menghitung jumlah MEK yang diperlukan untuk volume tertentu. Massa jenis MEK juga digunakan untuk menghitung volume molarnya, yaitu volume yang ditempati oleh satu mol MEK. Informasi ini berguna dalam berbagai eksperimen, termasuk menentukan massa molar suatu zat.
Berat Molekul MEK
Berat molekul MEK adalah 72,11 g/mol. Ini adalah jumlah berat atom atom dalam molekul MEK dan merupakan properti penting yang digunakan dalam banyak aplikasi, termasuk menghitung massa molar suatu zat. Berat molekul MEK dapat digunakan untuk mengubah massanya menjadi mol, yang berguna dalam banyak aplikasi, termasuk reaksi kimia, sintesis kimia, dan kimia analitik.
rumus MEK
Rumus kimia MEK adalah C4H8O. Rumus ini mewakili proporsi relatif.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 0,79 – 0,80 |
| Warna | Tanpa warna |
| Bau | Manis, buah |
| Masa molar | 72,11 g/mol |
| Kepadatan | 0,79 – 0,80 gram/mL |
| Titik fusi | -93,9°C (-136,0°F) |
| Titik didih | 80,6°C (176,5°F) |
| Titik kilat | 12°C (53,6°F) |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam sebagian besar pelarut organik |
| Tekanan uap | 38 mmHg (20°C) |
| Kepadatan uap | 2.3 (udara = 1) |
| pKa | 20.2 |
| pH | 7 (netral) |
Catatan: Nilai yang diberikan dalam tabel ini merupakan perkiraan dan mungkin sedikit berbeda tergantung pada sumber dan kondisi pengukuran.
Keamanan dan bahaya butanon
Butanon, juga dikenal sebagai metil etil keton, adalah cairan mudah terbakar dan mudah menguap yang dapat menyebabkan iritasi pada kulit, mata, dan saluran pernapasan jika tidak ditangani dengan tindakan pencegahan keselamatan yang tepat. Menghirup butanon konsentrasi tinggi dapat menyebabkan sakit kepala, pusing, mual dan kehilangan kesadaran. Paparan butanon konsentrasi rendah dalam waktu lama dapat menyebabkan kerusakan ginjal dan hati. Bahan ini juga sangat mudah terbakar dan mudah terbakar sehingga menimbulkan bahaya kebakaran. Saat menggunakan butanon, penting untuk bekerja di tempat yang berventilasi baik, mengenakan pakaian pelindung dan kacamata, dan menghindari kontak dengan kulit. Jika kena kulit atau mata, segera bilas dengan air dan konsultasikan dengan dokter jika perlu. Jika tertelan, jangan dimuntahkan dan segera dapatkan bantuan medis. Butanon harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari sumber panas dan api.
| Simbol bahaya | Cairan mudah terbakar, Mengiritasi |
| Deskripsi Keamanan | S2 – Jauhkan dari jangkauan anak-anak<br>S16 – Jauhkan dari sumber api<br>S24/25 – Hindari kontak dengan kulit dan mata<br>S26 – Jika kena mata, segera bilas dengan banyak air dan mencari nasihat medis |
| Sebuah pengidentifikasi | PBB1090 |
| kode HS | 29141100 |
| Kelas bahaya | 3 (Cairan mudah terbakar) |
| Kelompok pengepakan | II |
| Toksisitas | LD50 (oral, tikus) – 4,220 mg/kg |
Metode sintesis butanon
Butanon dapat disintesis dengan beberapa metode, termasuk oksidasi langsung 2-butanol dan kondensasi aldol aseton dan 2-propanol.
Metode oksidasi langsung melibatkan reaksi 2-butanol dengan zat pengoksidasi seperti asam kromat, hidrogen peroksida, atau campuran asam nitrat dan asam sulfat. Reaksi berlangsung dalam lingkungan asam dan metil etil keton yang dihasilkan dipisahkan dari campuran reaksi melalui distilasi.
Metode kondensasi aldol melibatkan reaksi aseton dengan 2-propanol dengan adanya basa kuat seperti natrium hidroksida atau kalium hidroksida. Reaksi tersebut menghasilkan campuran metil etil keton dan produk sampingan lainnya, yang dipisahkan melalui distilasi.
Metode sintesis lain melibatkan reaksi aseton dengan formaldehida dengan adanya katalis seperti asam sulfat atau asam p-toluenasulfonat. Reaksi ini menghasilkan campuran metil etil keton, formaldehida dan produk samping lainnya, yang dipisahkan melalui distilasi.
Secara keseluruhan, sintesis metil etil keton memerlukan pengendalian kondisi reaksi yang cermat untuk memastikan produksi produk berkualitas tinggi dengan produk sampingan minimal. Penting untuk mengikuti tindakan pencegahan keselamatan yang tepat ketika bekerja dengan bahan kimia dan reaksi yang terlibat dalam sintesis metil etil keton.
Kegunaan Butanon
Butanon, juga dikenal sebagai metil etil keton, memiliki banyak kegunaan industri karena solvabilitas, volatilitas, dan titik didihnya yang rendah. Beberapa kegunaan butanon yang paling umum meliputi:
- Pelarut: Metil etil keton digunakan sebagai pelarut berbagai zat seperti resin, perekat, tinta, pengupas cat, tinta cetak, pernis nitroselulosa dan karet sintetis.
- Bahan pembersih: Industri elektronik menggunakannya sebagai bahan pembersih untuk membersihkan bagian dan permukaan logam dari lemak, oli, dan kontaminan lainnya.
- Farmasi: Dalam industri farmasi, metil etil keton digunakan sebagai pelarut dalam produksi vaksin, antibiotik, dan obat-obatan lainnya.
- Pelapis: Pelapis untuk kayu, kertas dan bahan lainnya juga menggunakan metil etil keton sebagai pelarut dalam produksinya, serta dalam pembuatan pernis, lak dan pelapis pelindung lainnya.
- Parfum: Industri kosmetik dan makanan menggunakan metil etil keton sebagai pelarut untuk parfum dan perasa.
- Perekat: Perekat dan sealant juga menggunakan metil etil keton sebagai pelarut dalam produksinya.
Selain kegunaan industrinya, metil etil keton juga telah dipelajari potensinya sebagai bahan bakar. Kandungan energinya yang tinggi dan toksisitasnya yang rendah dibandingkan bahan bakar lain menjadikannya sumber energi alternatif yang menjanjikan.
Pertanyaan:
Apa reaksi berikut ini? katalis 2-butanon + h2/ni
Reaksi 2-butanon dengan gas hidrogen melalui katalis nikel dikenal sebagai reaksi hidrogenasi. Reaksi ini akan menghasilkan produk berikut:
2-butanon + H2 -> 2-butanol
Pengurangan ikatan rangkap antara atom karbon dan oksigen pada gugus keton 2-butanon menghasilkan pembentukan 2-butanol melalui aktivasi gas hidrogen oleh katalis nikel. Industri kimia biasanya menggunakan reaksi ini untuk menghasilkan 2-butanol, pelarut berharga dan bahan mentah untuk produksi bahan kimia lainnya. Kontrol yang cermat terhadap suhu, tekanan, dan jenis katalis diperlukan untuk hidrogenasi 2-butanon menjadi 2-butanol yang efisien dan selektif.
Apakah 2 butanon termasuk keton?
Kimia organik mencirikan 2-butanon, juga dikenal sebagai metil etil keton, sebagai sejenis keton dengan gugus karbonil (C=O) yang terikat pada atom karbon dalam rantai hidrokarbon. Gugus karbonil dari 2-butanon berada di antara dua atom karbon, oleh karena itu diberi label “metil etil keton”.
Berapa spektrum inframerah dari 2-butanon?
Spektrum IR (inframerah) 2-butanon (juga dikenal sebagai metil etil keton) dapat memberikan informasi penting tentang struktur molekul dan gugus fungsinya. Spektrum IR 2-butanon umumnya menunjukkan pita serapan utama berikut:
- Peregangan karbonil: Pita ini tampak sebagai puncak tajam antara 1700 dan 1700 cm^-1 dan merupakan karakteristik gugus fungsi C=O pada keton.
- Peregangan alkil: Puncak antara 2900 dan 3000 cm^-1 berhubungan dengan vibrasi regangan gugus CH2 dan CH3 dalam 2-butanon.
- Pembengkokan CH: Puncak antara 1400 dan 1500 cm^-1 berhubungan dengan getaran lentur ikatan CH dalam 2-butanon.
- Pembengkokan COC: Puncak antara 1300 dan 1400 cm^-1 berhubungan dengan vibrasi lentur gugus COC pada 2-butanon.
Penting untuk dicatat bahwa spektrum IR 2-butanon akan dipengaruhi oleh persiapan sampel dan instrumen yang digunakan, serta adanya pengotor atau kontaminan.
