2-Butanol adalah cairan tidak berwarna dan mudah terbakar dengan bau manis. Ini biasanya digunakan sebagai pelarut dan dalam produksi bahan kimia seperti metil etil keton dan butil asetat.
| Nama IUPAC | 2-Butanol |
| Formula molekul | C4H10O |
| nomor CAS | 78-92-2 |
| Sinonim | Butil alkohol kering, 2-butil alkohol, butan-2-ol, etilmetilkarbinol |
| Di ChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Sifat 2-butanol
rumus 2-butanol
Rumus kimia 2-Butanol adalah C4H10O, yang menunjukkan bahwa ia mengandung empat atom karbon, sepuluh atom hidrogen, dan satu atom oksigen. Ini adalah isomer butanol dan memiliki rumus struktur CH3CH(OH)CH2CH3. Angka “2” pada nama senyawa menunjukkan posisi gugus hidroksil pada rantai karbon.
Massa Molar 2-Butanol
Massa molar C4H10O adalah 74,12 g/mol. Nilai tersebut dapat diperoleh dengan menjumlahkan massa atom seluruh atom dalam senyawa, yaitu 12,01 g/mol untuk karbon, 1,01 g/mol untuk hidrogen, dan 16,00 g/mol untuk oksigen. Massa molar merupakan sifat penting C4H10O karena digunakan untuk menghitung jumlah senyawa yang dibutuhkan dalam reaksi kimia.
Titik didih 2-butanol
Titik didih C4H10O adalah 99,5 °C (211,1 °F) pada tekanan standar (1 atm). Ini adalah suhu di mana wujud cair suatu senyawa berubah menjadi gas. Titik didih C4H10O lebih tinggi dibandingkan butana (−0,5 °C) dan butena (−6,3 °C) karena ikatan hidrogen dan berat molekulnya.
Titik Leleh 2-Butanol
Titik leleh C4H10O adalah −114,7 °C (−174,5 °F). Ini adalah suhu di mana wujud padat suatu senyawa berubah menjadi wujud cair. Titik leleh C4H10O lebih rendah dibandingkan butana (−138,4 °C) dan butena (−185,3 °C) karena strukturnya yang bercabang dan ikatan hidrogennya.
Kepadatan 2-Butanol g/mL
Massa jenis C4H10O adalah 0,809 g/mL pada 25°C (77°F). Nilai ini menunjukkan massa senyawa per satuan volume suatu zat. Kepadatan C4H10O lebih tinggi dibandingkan butana (0,588 g/mL) dan butena (0,587 g/mL) karena berat molekul dan gaya antarmolekulnya.
Berat Molekul 2-Butanol
Berat molekul C4H10O adalah 74,12 g/mol. Ini adalah jumlah berat atom seluruh atom dalam molekul senyawa. Berat molekul digunakan untuk menghitung sifat-sifat senyawa lainnya, seperti massa molar, titik didih, dan massa jenis.
Struktur 2-butanol
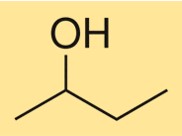
Struktur C4H10O dicirikan oleh rantai karbon bercabang dengan gugus hidroksil yang terikat pada atom karbon kedua. Ini adalah alkohol primer dengan pusat kiral, artinya ia ada sebagai dua stereoisomer, (R)-C4H10O dan (S)-C4H10O. Senyawa ini memiliki struktur tiga dimensi karena susunan atom karbon dan oksigen tetrahedral di sekitar gugus hidroksil.
Kelarutan 2-butanol
C4H10O merupakan senyawa polar dan sebagian larut dalam air. Kelarutan C4H10O dalam air adalah 80 g/L pada 25°C (77°F). Senyawa ini lebih larut dalam pelarut organik seperti etanol, eter dan aseton. Kelarutan C4H10O dipengaruhi oleh faktor-faktor seperti suhu, tekanan dan sifat pelarut.
| Penampilan | Cairan bening |
| Berat jenis | 0,810 g/mL pada 25°C (77°F) |
| Warna | Tanpa warna |
| Bau | Ciri |
| Masa molar | 74,12 g/mol |
| Kepadatan | 0,809 g/mL pada 25°C (77°F) |
| Titik fusi | −114,7°C (−174,5°F) |
| Titik didih | 99,5°C (211,1°F) pada tekanan 1 atm |
| Titik kilat | Cangkir tertutup 39°C (102°F). |
| Kelarutan dalam air | 80 g/L pada 25°C (77°F) |
| Kelarutan | Larut dalam etanol, eter dan aseton |
| Tekanan uap | 8,7 mmHg pada 25°C (77°F) |
| Kepadatan uap | 2.6 (udara = 1) |
| pKa | 16 |
| pH | 7.0-8.5 |
Keamanan dan bahaya 2-Butanol
C4H10O dianggap sebagai bahan kimia yang relatif aman bila ditangani dengan benar. Namun paparan dalam konsentrasi tinggi dapat menyebabkan iritasi pada mata, kulit, dan saluran pernapasan. Hal ini juga dapat menyebabkan sakit kepala, pusing dan mual. Menelan C4H10O dapat menyebabkan iritasi gastrointestinal dan kemungkinan depresi sistem saraf pusat. Selain itu, C4H10O mudah terbakar dan dapat menimbulkan bahaya kebakaran. Itu harus disimpan di tempat yang sejuk, kering, dan berventilasi baik, jauh dari sumber api. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat menangani bahan kimia ini. Tumpahan harus segera dibersihkan menggunakan prosedur yang tepat.
| Simbol bahaya | F, Xi |
| Deskripsi Keamanan | Jauhkan dari panas/percikan api/api terbuka/permukaan panas. Kenakan sarung tangan pelindung/pakaian pelindung/pelindung mata/pelindung wajah. JIKA TERKENA KULIT (atau rambut): Segera lepaskan semua pakaian yang terkontaminasi. Bilas kulit dengan air/pancuran. JIKA TERHIRUP: Pindahkan korban ke tempat berudara segar dan istirahatkan pada posisi yang nyaman untuk bernapas. JIKA TERTELAN: Bilas mulut. JANGAN memaksakan muntah. Hubungi PUSAT RACUN atau dokter jika Anda merasa tidak sehat. |
| Nomor identifikasi PBB | UN1120 |
| kode HS | 2905.13.00 |
| Kelas bahaya | 3 – Cairan yang mudah terbakar |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (lisan, tikus): 4,6 g/kg; LC50 (inhalasi, tikus): 2,100 ppm/4 jam |
Metode sintesis 2-butanol
Beberapa metode dapat digunakan untuk mensintesis C4H10O.
Salah satu metode melibatkan reduksi aseton menggunakan natrium borohidrida dengan adanya katalis nikel atau paladium. Reaksi tersebut menghasilkan campuran C4H10O dan isomernya, isobutanol, yang dapat dipisahkan dengan distilasi fraksional.
Metode lain melibatkan hidrasi 1-butena menggunakan asam sulfat sebagai katalis. Reaksi membentuk campuran C4H10O dan isomernya, tetapi C4H10O yang diinginkan dapat dipisahkan dengan distilasi fraksional.
Proses kimia Reppe melibatkan penggunaan katalis paladium atau nikel untuk mereaksikan asetilena dengan formaldehida dan air, menghasilkan pembentukan vinil alkohol. Reaksi ini selanjutnya mengarah pada sintesis C4H10O. Vinil alkohol kemudian mengalami hidrogenasi membentuk C4H10O.
Metode lain untuk mensintesis C4H10O melibatkan hidrogenasi crotonaldehyde dengan adanya katalis nikel. Reaksi tersebut menghasilkan campuran C4H10O dan isomernya, tetapi C4H10O yang diinginkan dapat diisolasi dengan distilasi fraksional.
Kegunaan 2-butanol
C4H10O memiliki beragam aplikasi di berbagai industri. Beberapa kegunaannya adalah:
- Pelarut: Digunakan sebagai pelarut dalam pembuatan resin, pernis dan pelapis. Juga digunakan sebagai pelarut selulosa eter dan ester.
- Bahan Bakar: Digunakan sebagai bahan tambahan biofuel karena toksisitasnya rendah dan kandungan energinya tinggi. Telah terbukti memiliki efisiensi pembakaran yang lebih tinggi dibandingkan etanol dan sedang dipelajari sebagai alternatif potensial pengganti bensin.
- Bahan antara kimia: digunakan sebagai bahan baku produksi bahan kimia lain seperti metil etil keton, metil isobutil keton, dan diisobutilena.
- Parfum dan Wewangian: Digunakan sebagai bahan pewangi dan penyedap dalam produksi parfum, sabun, dan produk perawatan pribadi lainnya.
- Reagen Laboratorium: Digunakan sebagai pelarut dan reagen dalam percobaan kimia organik.
- Agen Pembersih: Digunakan sebagai bahan pembersih pada produk pembersih industri dan rumah tangga.
- Tinta cetak: Juga digunakan sebagai pelarut dalam produksi tinta cetak.
Pertanyaan:
Q: Senyawa karbonil dan pereaksi Grignard manakah yang dapat digunakan untuk membuat 2-butanol?
A: Senyawa karbonil yang dapat digunakan untuk membuat C4H10O adalah butanal (juga dikenal sebagai n-butyraldehyde) dan pereaksi Grignard yang dapat digunakan adalah etil magnesium bromida. Reaksi antara butanal dan etilmagnesium bromida menghasilkan C4H10O sebagai produk akhir.
T: Apakah 2-butanol bersifat polar?
J: Ya, C4H10O bersifat polar. Ini mengandung gugus hidroksil (-OH), yang merupakan gugus fungsi polar yang membuat molekul menjadi polar.
Q: Apakah 2-butanol larut dalam air?
A: Ya, C4H10O larut sebagian dalam air. Gugus hidroksil polar C4H10O memungkinkannya membentuk ikatan hidrogen dengan molekul air, membuatnya agak larut dalam air.
Q: Apakah 2-butanol memiliki ikatan hidrogen?
A: Ya, C4H10O dapat membentuk ikatan hidrogen. Gugus hidroksil (-OH) pada C4H10O dapat membentuk ikatan hidrogen dengan molekul polar lain yang mengandung tempat ikatan hidrogen, seperti air.
