L’hypochlorite de magnésium (Mg(ClO)2) est un composé chimique composé de magnésium, d’oxygène et de chlore. Il est utilisé comme désinfectant, agent de blanchiment et produit chimique de traitement de l’eau.
| Nom de l’UICPA | Hypochlorite de magnésium |
| Formule moléculaire | Mg(ClO)2 |
| Numero CAS | 10233-03-1 |
| Synonymes | Chlorate de magnésium, sel de magnésium de l’acide hypochloreux, oxychlorure de magnésium, MagOCl |
| InChI | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Propriétés de l’hypochlorite de magnésium
Formule d’hypochlorite de magnésium
L’hypochlorite de magnésium a une formule chimique de Mg(ClO)2, ce qui signifie qu’il contient un atome de magnésium, deux atomes de chlore et deux atomes d’oxygène par molécule. Il s’agit d’un solide blanc avec une légère odeur de chlore et est couramment utilisé comme désinfectant et produit chimique pour le traitement de l’eau.
Hypochlorite De Magnésium Masse molaire
La masse molaire de Mg(ClO)2 est 127,21 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chaque élément de la formule chimique, à savoir le magnésium (24,31 g/mol), le chlore (35,45 g/mol) et l’oxygène (15,99 g/mol), multipliées par leurs indices respectifs.
Point d’ébullition de l’hypochlorite de magnésium
Le Mg(ClO)2 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, Mg(ClO)2 libère de l’oxygène gazeux, laissant derrière lui du chlorure de magnésium sous forme de résidu solide.
Hypochlorite de magnésium Point de fusion
Le point de fusion du Mg(ClO)2 est de 100 °C. À cette température, les cristaux solides de Mg(ClO)2 se transforment en liquide. Cependant, en raison de son instabilité à haute température, il est recommandé de le manipuler avec précaution.
Densité de l’hypochlorite de magnésium g/mL
La densité de Mg(ClO)2 est de 2,08 g/mL à température ambiante. Cela signifie qu’un millilitre de Mg(ClO)2 a une masse de 2,08 grammes.
Hypochlorite De Magnésium Poids moléculaire
Le poids moléculaire de Mg(ClO)2 est de 127,21 g/mol. C’est la somme des poids atomiques de tous les éléments du composé, à savoir le magnésium, le chlore et l’oxygène.
Structure de l’hypochlorite de magnésium
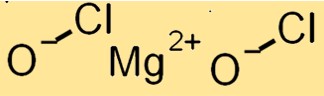
Mg(ClO)2 a une structure cristalline avec un système cristallin monoclinique. Il se compose de cations Mg+2 et d’anions ClO-, qui sont maintenus ensemble par des liaisons ioniques. Les anions ClO- sont dans un arrangement tétraédrique déformé autour des cations Mg+2.
Solubilité de l’hypochlorite de magnésium
Le Mg(ClO)2 est légèrement soluble dans l’eau, avec une solubilité de 14,6 g/100 mL à 20 °C. Il forme une solution légèrement basique dans l’eau en raison de l’hydrolyse des ions hypochlorite. Cependant, il n’est pas recommandé de dissoudre le Mg(ClO)2 dans l’eau car cela peut produire du chlore gazeux, qui est toxique et peut être nocif pour la santé humaine.
| Apparence | Solide blanc |
| Gravité spécifique | 2,08 g/mL à 20 °C |
| Couleur | Blanc |
| Odeur | Légèrement chloré |
| Masse molaire | 127,21 g/mole |
| Densité | 2,08 g/mL à 20 °C |
| Point de fusion | 100 °C |
| Point d’ébullition | Se décompose avant d’atteindre le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Légèrement soluble (14,6 g/100 mL à 20 °C) |
| Solubilité | Légèrement soluble dans l’eau, soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Solution légèrement basique |
Sécurité et dangers de l’hypochlorite de magnésium
Le Mg(ClO)2 peut être dangereux s’il n’est pas manipulé correctement. C’est un agent oxydant puissant qui peut réagir violemment avec certains produits chimiques. Le contact avec la peau, les yeux et les muqueuses peut provoquer des irritations et des brûlures. L’inhalation de poussière ou de brouillard peut provoquer des problèmes respiratoires. Il est également important d’éviter de mélanger du Mg(ClO)2 avec des acides ou d’autres composés contenant du chlore, car cela peut produire du chlore gazeux toxique. Il est recommandé de porter des équipements de protection tels que des gants et des lunettes lors de la manipulation du Mg(ClO)2 et de le stocker dans un endroit frais et sec, à l’écart des produits chimiques incompatibles.
| Symboles de danger | Agent oxydant, nocif |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes nues. Ne respirez pas la poussière ou le brouillard. Portez des gants et des lunettes de protection. |
| Numéros d’identification de l’ONU | ONU 1748 |
| Code SH | 2828.10.10 |
| Classe de danger | 5.1 (Agent comburant), 6.1 (Toxique) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) – 290 mg/kg ; CL50 (inhalation, rat) – 2,07 mg/L/4h ; Irritation cutanée – Légère ; Irritation des yeux – Sévère |
Méthodes de synthèse de l’hypochlorite de magnésium
Pour synthétiser du Mg(ClO)2, la méthode la plus couramment utilisée consiste à réagir avec de l’oxyde de magnésium avec du chlore gazeux.
Dans une méthode, pour produire du Mg(ClO)2, il faut mélanger de l’oxyde de magnésium avec du chlore gazeux en présence d’eau. Un contrôle minutieux est nécessaire pendant la réaction exothermique pour éviter la formation de sous-produits indésirables.
Une autre méthode implique la réaction entre l’hydroxyde de magnésium et l’acide hypochloreux. Pour maintenir le pH, la réaction a généralement lieu dans une solution d’hydroxyde de sodium. On peut séparer la solution résultante de Mg(ClO)2 par filtration puis la sécher après la réaction.
Une troisième méthode implique la réaction entre le carbonate de magnésium et l’acide hypochloreux. Cette réaction produit du Mg(ClO)2 et du dioxyde de carbone. Pour éviter la formation de sous-produits indésirables, il est nécessaire de surveiller attentivement la réaction.
Quelle que soit la méthode de synthèse utilisée, il est important de manipuler le Mg(ClO)2 avec précaution en raison de ses propriétés oxydantes et de ses dangers potentiels.
Utilisations de l’hypochlorite de magnésium
Le Mg(ClO)2 a plusieurs applications pratiques en raison de ses propriétés oxydantes et de sa capacité à libérer du chlore gazeux. Voici quelques utilisations courantes du Mg(ClO)2 :
- Traitement de l’eau : Couramment utilisé comme désinfectant dans les usines de traitement de l’eau pour tuer les bactéries et virus nocifs.
- Agent de blanchiment : utilisé comme agent de blanchiment pour les textiles, le papier et d’autres matériaux.
- Piscines : Utilisé comme agent désinfectant dans les piscines pour maintenir une bonne chimie de l’eau.
- Contrôle des odeurs : Utilisé pour contrôler les odeurs désagréables dans les usines de traitement des déchets et les systèmes d’égouts.
- Agent oxydant : utilisé comme agent oxydant dans la production de divers produits chimiques, tels que les époxydes et les cétones.
- Agriculture : Utilisé en agriculture comme désinfectant et pesticide pour lutter contre les maladies fongiques et bactériennes.
- Assainissement : Également utilisé comme désinfectant pour les surfaces et les équipements dans les hôpitaux, les usines de transformation des aliments et autres installations.
Des questions:
Q : Quelle est la formule de l’hypochlorite de magnésium ?
R : La formule de l’hypochlorite de magnésium est Mg(ClO)2.
Q : Quel est le niveau de pH de l’hypochlorite de magnésium ?
R : Le niveau de pH du Mg(ClO)2 dépend de sa concentration et peut varier. Cependant, une solution de Mg(ClO)2 a généralement un pH compris entre 8 et 10.
Q : Quelle est la formule moléculaire de l’hypochlorite de magnésium ?
R : La formule moléculaire de l’hypochlorite de magnésium est Mg(ClO)2.
Q : Quel est le nom de Mg(ClO)2 ?
R : Le nom de Mg(ClO)2 est hypochlorite de magnésium.
Q : Mg(ClO)2 est-il un acide ou une base ?
R : Mg(ClO)2 est un sel basique et peut agir comme une base faible dans les solutions aqueuses.
Q : Le Mg(ClO)2 est-il un sel ?
R : Oui, Mg(ClO)2 est du sel. Il s’agit d’un composé cristallin blanc hautement soluble dans l’eau et contenant à la fois un métal (magnésium) et un non-métal (chlore).
