L’hypochlorite de calcium (Ca(ClO)2) est un composé chimique couramment utilisé comme désinfectant et agent de blanchiment. Il est efficace pour tuer les bactéries, les virus et les algues dans le traitement de l’eau et l’assainissement.
| Nom UICPA | Hypochlorite de calcium |
| Formule moléculaire | Ca(ClO)2 |
| Numero CAS | 7778-54-3 |
| Synonymes | Sel de calcium de l’acide hypochloreux, Poudre décolorante, Chaux chlorée, Oxychlorure de calcium, HTH, Cal hypo |
| InChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Propriétés de l’hypochlorite de calcium
Formule d’hypochlorite de calcium
L’hypochlorite de calcium a la formule chimique Ca(ClO)2. C’est un solide cristallin blanc qui dégage une forte odeur de chlore. La formule de l’hypochlorite de calcium montre qu’il contient un ion Ca+2 et deux ions ClO-. L’ion hypochlorite a une charge négative et est responsable des fortes propriétés oxydantes du composé.
Hypochlorite De Calcium Masse molaire
La masse molaire de Ca(ClO)2 est de 142,98 g/mol. Il est calculé en additionnant les masses atomiques de calcium, de chlore et d’oxygène présentes dans une molécule de Ca(ClO)2. La masse molaire de Ca(ClO)2 est un paramètre important utilisé dans divers calculs chimiques.
Point d’ébullition de l’hypochlorite de calcium
Le Ca(ClO)2 se décompose avant d’atteindre son point d’ébullition. Son point d’ébullition n’est donc pas bien défini. Lorsque le Ca(ClO)2 est chauffé, il subit une décomposition thermique pour former du chlorure de calcium, de l’oxygène et du chlore gazeux.
Hypochlorite de calcium Point de fusion
Le point de fusion du Ca(ClO)2 est de 100 °C. À cette température, Ca(ClO)2 fond pour former un liquide clair. Le Ca(ClO)2 est très soluble dans l’eau et lorsqu’il se dissout dans l’eau, il libère des ions hypochlorite, ce qui en fait un désinfectant efficace.
Densité de l’hypochlorite de calcium g/mL
La densité de Ca(ClO)2 est de 2,35 g/mL. C’est un composé relativement dense et plus lourd que l’eau. La haute densité de Ca(ClO)2 est due à la présence d’ions calcium dans son réseau cristallin.
Hypochlorite De Calcium Poids moléculaire
Le poids moléculaire de Ca(ClO)2 est de 142,98 g/mol. Il est calculé en additionnant les masses atomiques de calcium, de chlore et d’oxygène présentes dans une molécule de Ca(ClO)2. Le poids moléculaire de Ca(ClO)2 est un paramètre important utilisé dans divers calculs chimiques.
Structure de l’hypochlorite de calcium
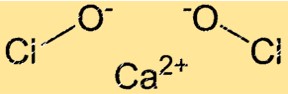
Ca(ClO)2 a une structure cristalline. Le réseau cristallin de Ca(ClO)2 est composé d’ions Ca+2 et d’ions ClO-. Les ions ClO- sont disposés selon une géométrie tétraédrique autour des ions Ca+2. La structure du réseau cristallin du Ca(ClO)2 lui confère ses fortes propriétés oxydantes.
Solubilité de l’hypochlorite de calcium
Ca(ClO)2 est très soluble dans l’eau. Il se dissout dans l’eau pour former un ion hypochlorite et un ion calcium. La solubilité du Ca(ClO)2 dans l’eau augmente avec l’augmentation de la température. Ca(ClO)2 est également soluble dans les solvants organiques tels que l’acétone et l’éthanol.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,35 |
| Couleur | Blanc |
| Odeur | Odeur de chlore |
| Masse molaire | 142,98 g/mole |
| Densité | 2,35 g/cm³ |
| Point de fusion | 100 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 21 g/100 ml (20 °C) |
| Solubilité | Soluble dans l’acétone, l’éthanol, le glycérol et l’eau |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7.5 |
| pH | ~11 |
Sécurité et dangers de l’hypochlorite de calcium
Le Ca(ClO)2 peut être dangereux s’il n’est pas manipulé correctement. C’est un oxydant puissant qui peut réagir violemment avec les composés organiques, libérant des gaz toxiques. Il peut provoquer une irritation de la peau et des yeux, et une exposition prolongée peut entraîner des problèmes respiratoires. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matières organiques, des agents réducteurs et des acides. Le Ca(ClO)2 doit être manipulé avec précaution et des équipements de protection, tels que des gants et des lunettes, doivent être portés lors de sa manipulation. Il ne doit pas être mélangé avec d’autres produits chimiques, notamment des acides ou des agents réducteurs, car cela pourrait provoquer une explosion.
| Symboles de danger | O, Xi, N |
| Description de la sécurité | Nocif en cas d’ingestion, provoque une irritation cutanée, provoque une sévère irritation des yeux, peut provoquer le cancer |
| Numéros d’identification de l’ONU | UN1748 |
| Code SH | 2828.90.00 |
| Classe de danger | 5.1 (Agents comburants) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) = 850 mg/kg ; CL50 (inhalation, rat) = 10,8 mg/m³ (exposition de 4 heures) |
Méthodes de synthèse de l’hypochlorite de calcium
Il existe plusieurs méthodes pour synthétiser Ca(ClO)2.
Une méthode consiste à mélanger du chlore gazeux avec de la chaux éteinte, également connue sous le nom d’hydroxyde de calcium , dans de l’eau. La réaction produit du Ca(ClO)2, du chlorure de calcium et de l’eau. Une autre méthode consiste à faire réagir du chlore gazeux avec de l’hydroxyde de calcium sec, ce qui donne du Ca(ClO)2 et de la vapeur d’eau.
Le processus de production de Ca(ClO)2 à grande échelle implique généralement la réaction de l’hypochlorite de sodium avec du chlorure de calcium , ce qui génère du Ca(ClO)2 et du chlorure de sodium.
Une autre méthode consiste à faire réagir du carbonate de calcium avec du chlore gazeux en présence d’eau ou d’acide acétique. La réaction produit du Ca(ClO)2, du dioxyde de carbone, de l’eau ou de l’acétate de calcium et de l’acide chlorhydrique.
Ces méthodes nécessitent une manipulation soigneuse et un équipement approprié pour garantir la sécurité et l’efficacité. Le choix de la méthode dépend de l’échelle de production et de la pureté souhaitée du produit final.
Utilisations de l’hypochlorite de calcium
Le Ca(ClO)2 a un large éventail d’utilisations en raison de ses fortes propriétés oxydantes et désinfectantes. Voici quelques utilisations courantes du Ca(ClO)2 :
- Traitement de l’eau : largement utilisé pour désinfecter l’eau des piscines, des systèmes d’eau potable et des usines de traitement des eaux usées.
- Agent de blanchiment : utilisé comme agent de blanchiment pour le coton, le lin et la pâte à papier, ainsi que dans la fabrication du papier et des textiles.
- Désinfection : Couramment utilisé pour désinfecter les surfaces et les équipements dans l’industrie agroalimentaire.
- Désodorisation : Utilisée pour éliminer les odeurs désagréables des tissus, tapis et autres matériaux.
- Désinfectant : Désinfectant efficace pour les hôpitaux, laboratoires et autres établissements de santé.
- Contrôle des algues : Utilisé pour contrôler la croissance des algues dans les plans d’eau, tels que les étangs et les lacs.
- Synthèse chimique : Utilisé dans la synthèse de divers composés organiques et inorganiques.
- Usage domestique : Utilisé comme désinfectant domestique, notamment pour nettoyer et désinfecter les toilettes et les canalisations.
- Forage de puits de pétrole : également utilisé dans le forage de puits de pétrole pour empêcher la croissance de bactéries et d’autres micro-organismes.
Des questions:
Q : Peut-on utiliser de l’hypochlorite de calcium pour enlever un tatouage ?
R : Non, le Ca(ClO)2 ne doit pas être utilisé pour enlever un tatouage. C’est un agent oxydant puissant qui peut provoquer de graves lésions cutanées et des cicatrices.
Q : Comment conserver l’hypochlorite de calcium ?
R : Le Ca(ClO)2 doit être stocké dans un endroit frais, sec et bien ventilé, à l’abri de la lumière directe du soleil, des sources de chaleur et des substances incompatibles. Il doit être conservé dans un récipient bien fermé et à l’abri de l’humidité et de l’eau.
Q : Où acheter de l’hypochlorite de calcium ?
R : Le Ca(ClO)2 peut être acheté auprès d’entreprises de fournitures chimiques, de magasins de fournitures pour piscine et de détaillants en ligne.
Q : Quelle quantité d’hypochlorite de calcium pour l’eau potable ?
R : La quantité de Ca(ClO)2 requise pour le traitement de l’eau potable dépend de la concentration de la solution et du volume d’eau à traiter. Le dosage recommandé se situe généralement entre 0,2 et 0,5 ppm (parties par million) pour une désinfection régulière.
Q : Quelle quantité d’hypochlorite de calcium peut-on ingérer en toute sécurité ?
R : Le Ca(ClO)2 ne doit jamais être ingéré, car il est hautement toxique et peut causer de graves problèmes de santé, voire la mort.
Q : Purification de l’eau à l’hypochlorite de calcium ?
R : Le Ca(ClO)2 est couramment utilisé pour la purification et la désinfection de l’eau dans divers contextes, notamment les piscines, les systèmes d’eau potable et les usines de traitement des eaux usées.
Q : Choc à l’hypochlorite de calcium ?
R : Le choc Ca(ClO)2 est un processus consistant à ajouter une concentration plus élevée de Ca(ClO)2 à une piscine ou à un spa pour augmenter rapidement les niveaux de chlore et éliminer les bactéries et contaminants nocifs.
Q : Hypochlorite de calcium pour désinfecter l’eau ?
R : Le Ca(ClO)2 est un désinfectant puissant qui est souvent utilisé pour le traitement et la purification de l’eau afin d’éliminer les bactéries, virus et autres micro-organismes nuisibles.
Q : Le Ca(OCl)2 est-il un acide ou une base ?
R : L’hypochlorite de calcium (Ca(OCl)2) est une base, car il peut accepter un proton pour former un ion hydroxyde.
Q : Quelle est la forme réduite de Ca(OCl)2 qui reste à la fin de l’expérience ?
R : La forme réduite de Ca(OCl)2 qui reste à la fin d’une expérience dépend de la réaction spécifique qui a lieu. Dans certains cas, il peut s’agir de chlorure de calcium (CaCl2) ou de carbonate de calcium (CaCO3).
