L’hydroxyde de zinc (Zn(OH)2) est une substance poudreuse blanche formée lorsque le zinc réagit avec l’eau. Il est utilisé dans diverses applications, notamment comme inhibiteur de corrosion et dans les onguents médicinaux.
| Nom UICPA | Hydroxyde de zinc |
| Formule moléculaire | Zn(OH)2 |
| Numero CAS | 20427-58-1 |
| Synonymes | Dihydroxyde de zinc; Hydroxyde de zinc(II) |
| InChI | InChI=1S/2H2O.Zn/h2*1H2;/q;;+2/p-2 |
Propriétés de l’hydroxyde de zinc
Formule d’hydroxyde de zinc
La formule du dihydroxyde de zinc est Zn(OH)2. Il se compose d’un ion Zn2+ lié à deux ions OH- par des liaisons ioniques. La formule indique que chaque ion zinc est entouré de deux groupes hydroxyde.
Hydroxyde De Zinc Masse molaire
La masse molaire du dihydroxyde de zinc (Zn(OH)2) est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le zinc (Zn) a une masse molaire d’environ 65,38 g/mol, tandis que la masse molaire d’un groupe OH- est d’environ 17,01 g/mol. La masse molaire du dihydroxyde de zinc est donc d’environ 99,42 g/mol.
Point d’ébullition de l’hydroxyde de zinc
Le dihydroxyde de zinc n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre la température d’ébullition. Lorsqu’il est chauffé, il se décompose en oxyde de zinc (ZnO) et en eau (H2O). Par conséquent, le dihydroxyde de zinc est plus couramment rencontré sous forme solide que sous sa forme liquide.
Point de fusion de l’hydroxyde de zinc
Le dihydroxyde de zinc a un point de fusion d’environ 125°C (257°F). A cette température, le solide Zn(OH)2 se transforme à l’état liquide. Il est essentiel de manipuler le dihydroxyde de zinc avec précaution pendant le chauffage pour éviter sa décomposition à des températures plus élevées.
Densité d’hydroxyde de zinc g/mL
La densité du dihydroxyde de zinc est d’environ 3,05 g/mL. Cette valeur de densité fait référence à la masse de dihydroxyde de zinc par unité de volume. La densité élevée indique que le dihydroxyde de zinc est un composé relativement lourd.
Hydroxyde de Zinc Poids moléculaire
Le poids moléculaire du dihydroxyde de zinc est d’environ 99,42 g/mol. Il représente la somme des poids atomiques de tous les atomes présents dans une molécule de Zn(OH)2, qui comprend l’atome de zinc et deux groupes hydroxyde.
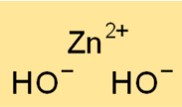
Structure de l’hydroxyde de zinc
Le dihydroxyde de zinc a une structure cristalline et se présente principalement sous la forme d’une poudre blanche et amorphe. Les ions Zn2+ sont entourés de deux ions OH- dans un arrangement tétraédrique.
Solubilité de l’hydroxyde de zinc
Le dihydroxyde de zinc est peu soluble dans l’eau, ce qui signifie qu’il se dissout dans une mesure limitée. Il peut se dissocier partiellement en ions Zn2+ et en ions OH- dans les solutions aqueuses. La solubilité du dihydroxyde de zinc est influencée par des facteurs tels que la température et le pH.
| Apparence | poudre blanche |
| Gravité spécifique | N’est pas applicable |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 99,42 g/mole |
| Densité | 3,05 g/ml |
| Point de fusion | 125°C (257°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Partiellement soluble, partiellement dissocié en ions Zn2+ et OH- |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcaline (de base) |
Sécurité et dangers de l’hydroxyde de zinc
Le dihydroxyde de zinc présente certaines considérations de sécurité et certains dangers. Lors de la manipulation de cette substance, il est essentiel de porter un équipement de protection individuelle approprié, tel que des gants et des lunettes de protection, pour éviter tout contact avec la peau et les yeux. En cas d’ingestion ou d’inhalation, consulter immédiatement un médecin. Évitez l’exposition à des températures élevées car il se décompose en produits dangereux. Conservez le dihydroxyde de zinc dans un endroit frais et sec, à l’écart des matières incompatibles. De plus, assurez une ventilation adéquate pendant la manipulation pour éviter l’accumulation de vapeurs potentiellement nocives. Suivez toujours les directives et réglementations de sécurité pour minimiser les risques et garantir une utilisation sûre.
| Symboles de danger | Non classés |
| Description de la sécurité | Portez un EPI ; Évitez tout contact avec la peau, les yeux et l’ingestion ; Consulter un médecin en cas d’exposition. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 28161000 |
| Classe de danger | Non classés |
| Groupe d’emballage | Non classés |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’hydroxyde de zinc
Diverses méthodes peuvent synthétiser le dihydroxyde de zinc.
Une approche courante implique la réaction entre des sels de zinc, tels que le chlorure de zinc ou le sulfate de zinc , et une base forte, généralement NaOH ou KOH . La réaction se déroule avec le déplacement des ions chlorure ou sulfate par des ions OH-, entraînant la formation de dihydroxyde de zinc.
Une autre méthode implique la précipitation du dihydroxyde de zinc à partir d’une solution de sel de Zn en utilisant un métal alcalin OH. Ajouter progressivement une solution aqueuse de sel de Zn à une solution d’ hydroxyde de sodium ou d’hydroxyde de potassium . Cela provoque la formation d’un précipité blanc de dihydroxyde de zinc.
Obtenez du dihydroxyde de zinc par électrolyse d’une solution de sulfate de zinc. Faites passer un courant électrique à travers la solution, provoquant la migration des ions zinc vers la cathode et leur réaction avec les molécules d’eau, conduisant au dépôt de dihydroxyde de zinc sur l’électrode.
Dans l’ensemble, ces méthodes de synthèse permettent de produire du dihydroxyde de zinc pour diverses applications industrielles, de recherche et médicales.
Utilisations de l’hydroxyde de zinc
Le dihydroxyde de zinc trouve de nombreuses applications dans divers domaines en raison de ses propriétés uniques. Certaines utilisations clés incluent :
- Inhibiteur de corrosion : le dihydroxyde de zinc inhibe la corrosion des revêtements et des peintures, protégeant les surfaces métalliques de l’oxydation et de la détérioration, prolongeant ainsi leur durée de vie.
- Pommades médicinales : Diverses pommades médicinales utilisent du dihydroxyde de zinc pour traiter les affections cutanées comme l’eczéma et l’érythème fessier, en raison de ses propriétés antiseptiques et astringentes.
- Ingrédient pharmaceutique actif (API) : Dans l’industrie pharmaceutique, les médicaments utilisés pour soulager les troubles de l’estomac, y compris les antiacides, incorporent du dihydroxyde de zinc comme ingrédient pharmaceutique actif.
- Traitement de l’eau : Les procédés de traitement de l’eau utilisent du dihydroxyde de zinc comme coagulant pour éliminer les impuretés et les polluants de l’eau.
- Industrie du caoutchouc : Dans l’industrie du caoutchouc, le dihydroxyde de zinc agit comme un accélérateur dans le processus de vulcanisation, améliorant ainsi la résistance et l’élasticité du caoutchouc.
- Adhésifs : La formulation des adhésifs et des colles incorpore du dihydroxyde de zinc pour offrir des propriétés de liaison améliorées.
- Siccatifs de peinture : le dihydroxyde de zinc fonctionne comme un siccatif dans les peintures à base d’huile, accélérant le processus de séchage.
- Agriculture : En agriculture, les agriculteurs appliquent du dihydroxyde de zinc comme fongicide pour protéger les cultures de diverses maladies fongiques.
- Ignifugeants : les fabricants incorporent du dihydroxyde de zinc comme additif ignifuge dans les plastiques et les textiles, réduisant ainsi leur inflammabilité.
Les applications polyvalentes du dihydroxyde de zinc en font un composé précieux dans de nombreuses industries, contribuant à améliorer les performances et la sécurité des produits.
Des questions:
Q : Quelles substances sont des acides parmi les suivantes : AgOH, HF, Ni(OH)2, NH4OH, HMnO4, Zn(OH)2 ?
R : HF (acide fluorhydrique) et HMnO4 (acide permanganique) sont des acides.
Q : Quel est le pH d’une solution saturée de Zn(OH)2 ? Ksp = 1,8 × 10^−14.
R : Le pH d’une solution saturée de Zn(OH)2 est d’environ 7, ce qui est neutre.
Q : Si la cellule E° est de -0,762 V, trouvez Ksp pour Zn(OH)2 ?
R : Le Ksp pour Zn(OH)2 est d’environ 4,5 × 10^−17.
Q : Qu’est-ce que le Zn(OH)2 ?
R : Zn(OH)2 est du dihydroxyde de zinc, une substance poudreuse blanche formée lorsque le zinc réagit avec l’eau.
Q : Quelle substance est importante dans la fabrication des plastiques ? Hydroxyde de zinc, ammoniaque, acide acétique, acide nitrique ?
R : Aucune des substances mentionnées n’est essentielle à la fabrication des plastiques.
Q : L’hydroxyde de zinc est-il soluble ?
R : Le dihydroxyde de zinc est peu soluble dans l’eau.
Q : Quelle est la formule chimique de l’hydroxyde de zinc ?
R : La formule chimique du dihydroxyde de zinc est Zn(OH)2.
Q : Que se forme-t-il lorsque le zinc réagit avec l’hydroxyde de sodium ?
R : Lorsque Zn réagit avec NaOH, du dihydroxyde de zinc (Zn(OH)2) se forme.
Q : L’hydroxyde de zinc est-il soluble dans l’eau ?
R : Le dihydroxyde de zinc est peu soluble dans l’eau.
Q : L’hydroxyde de zinc est-il une base forte ?
R : Le dihydroxyde de zinc est une base faible.
