L’hydroxyde de cuivre (Cu(OH)2) est un solide bleu formé par la réaction de sels de cuivre avec des ions hydroxyde. Il est utilisé comme fongicide et dans divers procédés chimiques.
| Nom UICPA | Hydroxyde de cuivre(II) |
| Formule moléculaire | Cu(OH)2 |
| Numero CAS | 20427-59-2 |
| Synonymes | Hydroxyde de cuivre ; Dihydroxyde de cuivre ; CuOH2 |
| InChI | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Propriétés de l’hydroxyde de cuivre
Formule d’hydroxyde de cuivre
La formule chimique de l’hydroxyde cuivrique est Cu(OH)2. Il représente la combinaison d’un ion cuivre (Cu2+) et de deux ions OH- maintenus ensemble par des liaisons ioniques. Ce composé solide bleu est couramment utilisé dans diverses industries en raison de ses propriétés uniques.
Hydroxyde De Cuivre Masse molaire
La masse molaire de l’hydroxyde cuivrique (Cu(OH)2) peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le cuivre (Cu) a une masse atomique d’environ 63,55 g/mol et chaque ion OH- a une masse atomique combinée d’environ 17,01 g/mol. La masse molaire de l’hydroxyde cuivrique est donc d’environ 97,55 g/mol.
Point d’ébullition de l’hydroxyde de cuivre
L’hydroxyde de cuivre n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il subit une réaction de décomposition thermique pour former de l’oxyde de cuivre et de la vapeur d’eau.
Point de fusion de l’hydroxyde de cuivre
L’hydroxyde de cuivre a un point de fusion d’environ 200°C (392°F). A cette température, le solide subit une transition de phase et se transforme en état liquide.
Densité d’hydroxyde de cuivre g/mL
La densité de l’hydroxyde cuivrique est d’environ 3,36 g/mL. Cette valeur représente la masse d’un millilitre d’hydroxyde cuivrique, indiquant sa compacité et sa concentration.
Hydroxyde De Cuivre Poids moléculaire
Le poids moléculaire de l’hydroxyde cuivrique est d’environ 97,55 g/mol. Il est calculé en additionnant les poids atomiques de tous les atomes présents dans une molécule d’hydroxyde cuivrique.
Structure de l’hydroxyde de cuivre
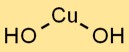
L’hydroxyde cuivrique adopte une structure cristalline, avec des ions Cu2+ entourés d’ions OH- dans un arrangement plan trigonal. Cet arrangement de réseau cristallin contribue à sa stabilité et à ses propriétés distinctives.
Solubilité de l’hydroxyde de cuivre
L’hydroxyde cuivrique présente une solubilité limitée dans l’eau. Il forme une suspension peu soluble dans l’eau, ce qui signifie que seule une petite quantité du composé se dissout dans le solvant. La solubilité peut être influencée par des facteurs tels que la température et le pH.
| Apparence | Bleu solide |
| Gravité spécifique | ~3,36 g/mL |
| Couleur | Bleu |
| Odeur | Inodore |
| Masse molaire | ~97,55 g/mole |
| Densité | ~3,36 g/mL |
| Point de fusion | ~200°C (392°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Limité, varie en fonction de la température et des niveaux de pH |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | Alcaline (de base) |
Sécurité et dangers de l’hydroxyde de cuivre
L’hydroxyde de cuivre pose certaines considérations de sécurité et de danger. Il est généralement considéré comme peu toxique, mais peut provoquer une irritation de la peau, des yeux et des voies respiratoires par contact ou par inhalation. Des mesures de protection adéquates, telles que le port de gants et de lunettes de sécurité, doivent être prises lors de la manipulation de ce composé. En cas d’ingestion ou d’exposition accidentelle, des soins médicaux immédiats sont nécessaires. De plus, l’hydroxyde de cuivre doit être stocké dans un endroit sécurisé et bien ventilé, à l’écart des substances incompatibles. Des procédures d’élimination appropriées doivent être suivies pour éviter la contamination de l’environnement. Le respect des consignes de sécurité est crucial pour minimiser les risques potentiels associés à l’hydroxyde de cuivre.
| Symboles de danger | Aucun |
| Description de la sécurité | Faible toxicité ; Irritant |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2825.90.5000 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | Non classés |
| Toxicité | Faible |
Méthodes de synthèse de l’hydroxyde de cuivre
Plusieurs méthodes actives permettent de synthétiser l’hydroxyde cuivrique.
Une approche courante implique la réaction d’un sel de Cu, tel que CuSO4 , avec une base forte comme l’hydroxyde de sodium (NaOH) ou l’hydroxyde de potassium (KOH) . Au cours de ce processus, les ions hydroxyde (OH-) de la base déplacent les ions sulfate (SO4^2-) dans le CuSO4 , formant de l’hydroxyde cuivrique (Cu(OH)2) sous forme de précipité bleu.
Une autre méthode implique la réaction d’un sel de cuivre (II) avec de l’ammoniac (NH3). En ajoutant de l’ammoniac à une solution de Cu(II), l’hydroxyde cuivrique précipite en raison de la combinaison des ions Cu2+ avec les ions hydroxyde de l’ammoniac.
L’électrolyse permet la synthèse d’hydroxyde cuivrique en immergeant une électrode de Cu dans une solution électrolytique et en appliquant un courant électrique continu. La réduction de l’eau à la cathode génère des ions hydroxyde, conduisant à la formation d’hydroxyde cuivrique.
Ces méthodes de synthèse active offrent des moyens contrôlés et efficaces de produire de l’hydroxyde cuivrique pour diverses applications industrielles et de recherche.
Utilisations de l’hydroxyde de cuivre
L’hydroxyde de cuivre trouve de multiples applications dans diverses industries en raison de ses propriétés uniques et de sa nature polyvalente. Certaines utilisations notables incluent :
- Fongicide : Les agriculteurs l’utilisent largement comme fongicide protecteur pour lutter contre les maladies fongiques dans les cultures telles que les fruits, les légumes et les plantes ornementales.
- Intermédiaires chimiques : Il sert d’intermédiaire chimique précieux dans la synthèse de divers composés de cuivre, comme l’oxyde de cuivre et les sels de cuivre.
- Agent de préservation du bois : Il traite le bois et offre une protection contre les insectes xylophages et les champignons responsables de la pourriture, prolongeant ainsi la durée de vie des structures en bois.
- Agent antibactérien : Dans certaines formulations, il agit comme un agent antibactérien, trouvant des applications dans les milieux médicaux et de soins de santé.
- Traitement aquatique : Il aide à gérer les algues et les mauvaises herbes aquatiques dans les étangs, les lacs et autres plans d’eau, en maintenant l’équilibre écologique.
- Industrie de la céramique et du verre : les fabricants l’utilisent comme colorant pour conférer des teintes bleues et vertes vibrantes aux produits en céramique et en verre.
- Pyrotechnie : Il contribue à la coloration des feux d’artifice et des fusées éclairantes, jouant un rôle dans les applications pyrotechniques.
- Fabrication de batteries : elle trouve son utilité dans la production de batteries en tant que matériau d’électrode, facilitant le stockage de l’énergie.
- Peinture et revêtements : Certaines formulations de peinture l’incorporent pour conférer des propriétés protectrices et antimicrobiennes.
La diversité des applications met en valeur l’importance de l’hydroxyde de cuivre dans de multiples industries, ce qui en fait un composé précieux pour diverses utilisations pratiques.
Des questions:
Q : L’hydroxyde de cuivre est-il soluble ?
R : L’hydroxyde cuivrique a une solubilité limitée dans l’eau, formant une suspension peu soluble.
Q : Combien de moles y a-t-il dans 68 grammes d’hydroxyde de cuivre (II) Cu(OH)2 ?
R : Il y a environ 0,697 mole de Cu(OH)2 dans 68 grammes.
Q : L’hydroxyde de cuivre II est-il soluble dans l’eau ?
R : L’hydroxyde de Cupric II a une solubilité limitée dans l’eau.
Q : L’hydroxyde de sodium et le sulfate de cuivre sont-ils une réaction chimique ?
R : Oui, la réaction entre NaOH et CuSO4 entraîne la formation d’hydroxyde cuivrique et de sulfate de sodium.
Q : L’hydroxyde de cuivre (II) est-il soluble ?
R : L’hydroxyde de cuivre (II) a une solubilité limitée dans l’eau.
Q : Quelle est la couleur de l’hydroxyde de cuivre ?
R : L’hydroxyde cuivrique est de couleur bleue.
Q : L’hydroxyde de cuivre est-il un alcali ?
R : L’hydroxyde de cuivre est une base mais n’est pas classé comme alcali.
Q : L’hydroxyde de cuivre est-il une base forte ?
R : L’hydroxyde de cuivre n’est pas considéré comme une base forte.
Q : Le Cu(OH)2 est-il soluble dans l’eau ?
R : Cu(OH)2 a une solubilité limitée dans l’eau.
Q : Combien de moles y a-t-il dans 68 grammes d’hydroxyde de cuivre (II) Cu(OH)2 ?
R : Il y a environ 0,697 mole de Cu(OH)2 dans 68 grammes.
Q : Combien de moles y a-t-il dans 34 grammes de Cu(OH)2 ?
R : Il y a environ 0,3485 mole de Cu(OH)2 dans 34 grammes.
Q : Un Cu(OH)2 solide se forme-t-il lorsque 0,075 g de KOH est dissous dans 1,0 L de Cu(NO3)2 à 1,0 × 10^−3 M ?
R : Oui, le Cu(OH)2 solide se forme sous forme de précipité en raison de la réaction entre KOH et Cu(NO3)2.
