L’hydroxyde de calcium (Ca(OH)2) est un composé chimique utilisé dans diverses applications telles que la production alimentaire, le traitement de l’eau et la construction. Il est fabriqué en mélangeant de l’oxyde de calcium avec de l’eau et a un aspect blanc et poudreux.
| Nom de l’UICPA | Hydroxyde de calcium |
| Formule moléculaire | Ca(OH)2 |
| Numero CAS | 1305-62-0 |
| Synonymes | Chaux éteinte, chaux hydratée, lait de chaux, chaux décapante |
| InChI | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Propriétés de l’hydroxyde de calcium
Formule d’hydroxyde de calcium
La formule chimique de l’hydroxyde de calcium est Ca(OH)2. Cela signifie que chaque molécule d’hydroxyde de calcium contient un ion Ca2+ et deux ions OH-. La formule est importante en chimie, car elle représente le nombre et les types d’atomes d’un composé.
Hydroxyde De Calcium Masse molaire
Ca(OH)2 a une masse molaire de 74,09 g/mol. Il est composé d’un atome de calcium, de deux atomes d’oxygène et de deux atomes d’hydrogène. La masse molaire est une propriété importante en chimie, car elle est utilisée pour calculer la quantité d’une substance dans un échantillon donné.
Point d’ébullition de l’hydroxyde de calcium
Ca(OH)2 a un point d’ébullition très élevé de 2 400°C. Cela signifie qu’il faut une quantité importante de chaleur pour le transformer d’un liquide en gaz. Le point d’ébullition élevé est dû aux fortes liaisons ioniques entre les ions calcium et hydroxyde.
Point de fusion de l’hydroxyde de calcium
Ca(OH)2 a un point de fusion relativement bas de 580°C. Cela signifie qu’il peut être facilement fondu et moulé sous différentes formes. Le faible point de fusion est dû à la nature ionique du composé, qui permet aux ions de se déplacer plus librement lorsqu’ils sont chauffés.
Densité d’hydroxyde de calcium g/mL
La densité de Ca(OH)2 est de 2,24 g/mL. Cela signifie qu’il s’agit d’un composé relativement lourd, comparé à l’eau qui a une densité de 1 g/mL. La densité élevée est due à la nature très compacte des ions Ca2+ et OH-.
Hydroxyde De Calcium Poids moléculaire
Le poids moléculaire de Ca(OH)2 est de 74,09 g/mol. Il s’agit de la somme des poids atomiques des atomes de calcium, d’oxygène et d’hydrogène du composé. Le poids moléculaire est une propriété importante en chimie, car il est utilisé pour calculer divers paramètres tels que la molarité et le pourcentage de composition.
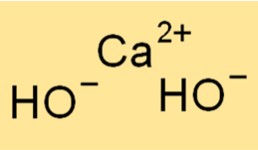
Structure de l’hydroxyde de calcium
Ca(OH)2 a une structure cristalline, chaque ion calcium étant entouré de six ions hydroxyde dans un arrangement octaédrique. Cette structure confère au composé son aspect blanc et poudré caractéristique. Les liaisons ioniques entre les ions Ca2+ et OH- sont fortes, ce qui confère au composé ses points de fusion et d’ébullition élevés.
| Apparence | poudre blanche |
| Gravité spécifique | 2,24 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 74,09 g/mole |
| Densité | 2,24 g/cm³ |
| Point de fusion | 580 °C |
| Point d’ébullition | 2 400 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 1,7 g/L (20 °C) |
| Solubilité | Soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 12.5 (première dissociation) |
| pH | 12,5 (solution 0,1 M, 25 °C) |
Sécurité et dangers de l’hydroxyde de calcium
Le Ca(OH)2 est généralement considéré comme sûr lorsqu’il est manipulé correctement. Cependant, il peut être dangereux s’il est ingéré, inhalé ou s’il entre en contact avec la peau ou les yeux. Cela peut provoquer des irritations, des brûlures et des problèmes respiratoires. La poussière provenant du composé peut également irriter le système respiratoire. Des équipements de protection tels que des gants, des lunettes et des respirateurs doivent être portés lors de la manipulation du Ca(OH)2. Le composé doit également être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles. En cas de contact ou d’ingestion, consulter immédiatement un médecin.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Porter des gants de protection et une protection pour les yeux/le visage. |
| Numéros d’identification de l’ONU | ONU 1910 |
| Code SH | 2825.90.90 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | III |
| Toxicité | L’hydroxyde de calcium est généralement considéré comme non toxique lorsqu’il est manipulé correctement. Cependant, l’ingestion ou l’inhalation peut irriter et brûler le système respiratoire et le tube digestif. |
Méthodes de synthèse de l’hydroxyde de calcium
Diverses méthodes peuvent synthétiser Ca(OH)2.
Une méthode courante pour synthétiser le Ca(OH)2 consiste à faire réagir l’eau avec de l’oxyde de calcium , entraînant la formation de chaux éteinte ou de chaux hydratée.
Une autre méthode implique la réaction du chlorure de calcium avec l’hydroxyde de sodium. La réaction de l’eau et du dioxyde de carbone avec le carbonate de calcium produit du Ca(OH)2.
Le processus d’hydratation consiste à mélanger de l’eau avec de l’oxyde de calcium selon la méthode à la chaux éteinte. Cette réaction produit du Ca(OH)2 et de la chaleur comme sous-produit. Le processus élimine en outre les impuretés et l’excès d’eau de la pâte obtenue.
La méthode au chlorure de calcium consiste à mélanger du chlorure de calcium et de l’hydroxyde de sodium selon un processus appelé double décomposition.
Cette réaction produit du Ca(OH)2 et du chlorure de sodium comme sous-produits. Le Ca(OH)2 résultant est ensuite purifié et séché.
Dans la méthode au carbonate de calcium, le carbonate de calcium est d’abord chauffé pour produire de l’oxyde de calcium et du dioxyde de carbone. Le processus d’hydratation consiste à mélanger de l’oxyde de calcium avec de l’eau, ce qui produit du Ca(OH)2.
Utilisations de l’hydroxyde de calcium
Le Ca(OH)2 a de nombreuses utilisations dans diverses industries, notamment :
- Construction : Utilisé comme élément clé dans la production de béton, de mortier et de stuc en raison de sa capacité à renforcer et à augmenter la durabilité de ces matériaux.
- Agriculture : Utilisé comme amendement du sol pour réduire l’acidité du sol et améliorer la fertilité du sol.
- Traitement de l’eau : Utilisé pour adoucir l’eau en éliminant les impuretés telles que les ions magnésium et calcium.
- Fabrication de produits chimiques : utilisé dans la production de divers produits chimiques tels que le stéarate de calcium, l’hypochlorite de calcium et le phosphate de calcium.
- Industrie alimentaire : utilisé comme additif alimentaire pour réguler les niveaux d’acidité des produits alimentaires tels que les cornichons, les olives et les boissons gazeuses.
- Industrie médicale : Utilisé dans diverses procédures dentaires, telles que les traitements canalaires et les obturations de cavités, en raison de ses propriétés antimicrobiennes et antifongiques.
- Industrie des pâtes et papiers : Utilisé dans la production de papier pour améliorer la brillance et la résistance du papier.
- Industrie du cuir : Utilisé dans la transformation du cuir pour éliminer les poils et les impuretés.
Des questions:
Q : L’hydroxyde de calcium est-il soluble ?
R : Ca(OH)2 est modérément soluble dans l’eau, avec une solubilité d’environ 1,2 g/L à température ambiante.
Q : Quelle est la formule de l’hydroxyde de calcium ?
R : La formule de l’hydroxyde de calcium est Ca(OH)2.
Q : Où acheter de l’hydroxyde de calcium près de chez moi ?
R : Le Ca(OH)2 peut être acheté dans les magasins de produits chimiques, les quincailleries ou les détaillants en ligne. Vous pouvez rechercher des magasins de produits chimiques ou des quincailleries à proximité de votre région ou consulter des détaillants en ligne tels qu’Amazon ou eBay.
Q : Le Ca(OH)2 est-il un acide ou une base ?
R : Ca(OH)2 est une base. C’est une base forte qui se dissocie complètement dans l’eau pour former des ions calcium (Ca2+) et des ions hydroxyde (OH-).
Q : Lorsque la réaction H3PO4(aq)+Ca(OH)2(aq)→ se produit, quelle est la formule du sel formé ?
R : La réaction entre H3PO4(aq) et Ca(OH)2(aq) produit du phosphate de calcium (Ca3(PO4)2) et de l’eau (H2O) comme sel et sous-produit, respectivement.
Q : Le Ca(OH)2 est-il soluble dans l’eau ?
R : Oui, Ca(OH)2 est modérément soluble dans l’eau. Il peut se dissoudre dans l’eau pour former une solution saturée avec une concentration d’environ 1,2 g/L à température ambiante.
Q : Le Ca(OH)2 est-il une base forte ?
R : Oui, Ca(OH)2 est une base forte. C’est un composé hautement basique qui se dissocie complètement dans l’eau pour former des ions Ca2+ et OH-, ce qui en fait une base forte.
Q : Lesquels sont produits lorsque HCl réagit avec Ca(OH)2 ?
R : Lorsque HCl réagit avec Ca(OH)2, les produits formés sont du chlorure de calcium (CaCl2) et de l’eau (H2O), car les ions H+ de HCl réagissent avec les ions OH- de Ca(OH)2 pour former de l’eau, tandis que les ions Ca2+ et Cl- restants forment le sel, le chlorure de calcium.
