L’hydroxyde de baryum est un composé chimique de formule Ba(OH)2. Il s’agit d’un solide cristallin blanc hautement soluble dans l’eau et couramment utilisé dans les laboratoires et les processus industriels.
| Nom UICPA | Dihydroxyde de baryum |
| Formule moléculaire | Ba(OH)2 |
| Numero CAS | 17194-00-2 |
| Synonymes | Hydroxyde de baryum (II), baryte, hydrate de baryum, dihydrate de baryum, bis (hydroxyde de baryum), bis (oxydanyl) de baryum hydraté |
| InChI | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Masse molaire de l’hydroxyde de baryum
L’hydroxyde de baryum a une masse molaire de 171,34 g/mol. Il est composé d’un ion baryum (Ba2+) et de deux ions hydroxyde (OH-), chacun ayant une masse molaire de 137,33 g/mol et 17,01 g/mol, respectivement. La masse molaire de l’hydroxyde de baryum est importante pour déterminer la quantité de composé nécessaire aux réactions ou pour calculer la concentration d’une solution.
Formule d’hydroxyde de baryum
La formule chimique de l’hydroxyde de baryum est Ba(OH)2. Il se compose d’un ion baryum (Ba2+) et de deux ions hydroxyde (OH-). La formule de l’hydroxyde de baryum est importante pour déterminer la quantité de composé nécessaire dans les réactions ou pour calculer la concentration d’une solution. Il est également utilisé pour représenter la structure du composé et son comportement en solution.
Point d’ébullition de Ba(OH)2
Le point d’ébullition du Ba(OH)2 n’est pas bien défini, car il se décompose avant d’être bouilli. Ba(OH)2 est une base forte et réagit facilement avec le dioxyde de carbone présent dans l’air, formant du carbonate de baryum et de l’eau. La température de décomposition de Ba(OH)2 dépend de la concentration de la solution, mais est généralement supérieure à 780°C.
Ba(OH)2 point de fusion
Ba(OH)2 a un point de fusion de 407°C. Il existe à l’état solide sous forme de cristaux blancs et inodores. Lorsqu’il est chauffé, Ba(OH)2 subit une réaction réversible pour former de l’oxyde de baryum et de l’eau. Le point de fusion du Ba(OH)2 est important pour déterminer la température à laquelle il peut être manipulé et stocké en toute sécurité.
Ba(OH)2 densité g/ml
La densité du solide Ba(OH)2 est de 3,22 g/cm3. En solution, la densité varie en fonction de la concentration. Par exemple, une solution à 10 % de Ba(OH)2 a une densité de 1,17 g/cm3. La densité de Ba(OH)2 est importante pour déterminer le volume d’une solution nécessaire aux réactions ou lors de la manipulation du composé.
Ba(OH)2 poids moléculaire
Le poids moléculaire de Ba(OH)2 est de 171,34 g/mol. C’est la somme des poids atomiques d’un ion baryum et de deux ions hydroxyde. Le poids moléculaire de Ba(OH)2 est important pour déterminer la quantité de composé nécessaire dans les réactions ou pour calculer la concentration d’une solution.
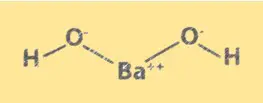
Structure Ba(OH)2
Ba(OH)2 a une structure cristalline similaire à celle du chlorure de sodium. Il se compose d’ions Ba2+ et d’ions OH-, disposés dans un réseau cubique. Les ions Ba2+ occupent les coins du cube et les ions OH- occupent le centre de chaque face. La structure de Ba(OH)2 est importante pour comprendre ses propriétés chimiques et son comportement en solution.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 3,22 g/cm3 (solide) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 171,34 g/mole |
| Densité | 2,18 g/cm3 (solution aqueuse, 10 % p/p à 25°C) |
| Point de fusion | 407°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans l’alcool et l’acétone |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcalin (pH > 7) |
Remarque : Les valeurs fournies dans ce tableau sont des descriptions générales et peuvent varier en fonction des conditions spécifiques et des concentrations de la substance.
Hydroxyde de baryum Sécurité et dangers
Ba(OH)2 est une substance hautement caustique et toxique qui peut provoquer de graves irritations de la peau, des yeux et des voies respiratoires. Il est important de le manipuler avec prudence et de porter un équipement de protection individuelle approprié, comme des gants et des lunettes de sécurité. En cas d’inhalation ou d’ingestion, il peut causer de graves dommages aux poumons, au système digestif et aux reins. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matières incompatibles telles que les acides et les oxydants. En cas de déversement ou d’exposition, suivez les procédures d’urgence appropriées, comme évacuer la zone et consulter immédiatement un médecin.
| Symboles de danger | Corrosif |
| Description de la sécurité | Eviter le contact avec la peau et les yeux; Portez des vêtements et des gants de protection ; Utiliser uniquement dans des zones bien ventilées |
| Identifiants ONU | ONU 1564 |
| Code SH | 2816.40.00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Toxique par ingestion, inhalation et absorption cutanée ; Provoque une grave irritation de la peau et des yeux ; Peut provoquer une irritation des voies respiratoires et des lésions rénales |
Méthodes de synthèse de l’hydroxyde de baryum
Ba(OH)2 peut être synthétisé par plusieurs méthodes, notamment la réaction de l’oxyde de baryum (BaO) avec de l’eau (H2O) ou la réaction du chlorure de baryum (BaCl2) avec l’hydroxyde de sodium (NaOH).
Dans la première méthode, l’oxyde de baryum est ajouté lentement à l’eau distillée sous agitation constante jusqu’à ce que la concentration souhaitée soit atteinte. La solution résultante est ensuite filtrée et séchée pour obtenir la forme solide de Ba(OH)2.
Dans la deuxième méthode, une solution de chlorure de baryum est ajoutée lentement à une solution d’hydroxyde de sodium sous agitation constante jusqu’à ce que le pH souhaité soit atteint. La solution résultante est ensuite filtrée et séchée pour obtenir la forme solide de Ba(OH)2.
Une autre méthode implique la réaction du sulfure de baryum (BaS) avec de l’eau, produisant du Ba(OH)2 et du sulfure d’hydrogène gazeux (H2S).
Ba(OH)2 peut également être préparé par électrolyse de sels de baryum fondus ou par décomposition thermique du carbonate de baryum (BaCO3) à haute température.
Dans l’ensemble, la synthèse de Ba(OH)2 nécessite une manipulation soigneuse et des précautions de sécurité appropriées en raison de ses propriétés hautement caustiques et toxiques. Il est important de suivre les protocoles et réglementations de sécurité appropriés lorsque vous travaillez avec des matières dangereuses.
Utilisations de l’hydroxyde de baryum
Ba(OH)2 a plusieurs utilisations industrielles et en laboratoire en raison de sa nature hautement réactive et de ses propriétés alcalines. L’une de ses principales utilisations est celle de réactif chimique dans la production de divers produits chimiques, notamment des lubrifiants, des plastiques et des pesticides.
Ba(OH)2 est également utilisé comme stabilisant dans le PVC et d’autres plastiques pour prévenir la décoloration et la dégradation causées par la chaleur et l’exposition aux rayons UV. Il est également utilisé dans la production de certains types de verre, comme le verre optique et le verre à indice de réfraction élevé.
En laboratoire, Ba(OH)2 est utilisé comme catalyseur dans diverses réactions organiques, telles que les réactions d’estérification et de transestérification. Il est également utilisé comme titrant en chimie analytique pour la détermination des acides faibles et dans la préparation de solutions étalons.
Une autre application du Ba(OH)2 est la production d’oxyde de baryum, utilisé dans la fabrication de tubes cathodiques pour téléviseurs et écrans d’ordinateur.
Ba(OH)2 est également utilisé dans le traitement des eaux usées industrielles pour éliminer les impuretés et neutraliser les effluents acides ou alcalins avant rejet dans l’environnement.
Dans l’ensemble, Ba(OH)2 joue un rôle essentiel dans de nombreuses industries et laboratoires, contribuant à la production de nombreux produits et processus.
Des questions:
L’hydroxyde de baryum est-il soluble ?
Oui, l’hydroxyde de baryum est soluble dans l’eau. Lorsqu’il est dissous dans l’eau, il forme une solution alcaline dont le pH est d’environ 12,5. La solubilité du Ba(OH)2 dans l’eau est relativement élevée, avec une solubilité d’environ 3,52 g/100 mL à température ambiante (25 °C). La solubilité du Ba(OH)2 peut être affectée par des facteurs tels que la température, la pression et la présence d’autres substances dans la solution.
L’hydroxyde de baryum est-il une base forte ?
Oui, l’hydroxyde de baryum est une base forte. Lorsqu’il est dissous dans l’eau, il se dissocie complètement pour former des ions baryum (Ba2+) et des ions hydroxyde (OH-) dans la solution. Cette dissociation produit une solution hautement alcaline avec un pH d’environ 12,5. Les fortes propriétés basiques du Ba(OH)2 en font un neutralisant efficace des effluents acides et un catalyseur dans diverses réactions organiques.
Quelle est la formule de l’hydroxyde de baryum ?
La formule de l’hydroxyde de baryum est Ba(OH)2. Cette formule indique que chaque molécule d’hydroxyde de baryum contient un ion baryum (Ba2+) et deux ions hydroxyde (OH-). L’ion baryum a une charge +2, tandis que l’ion hydroxyde a une charge -1. Les deux ions hydroxyde dans Ba(OH)2 équilibrent la charge +2 de l’ion baryum pour créer un composé neutre. La formule de Ba(OH)2 est importante pour comprendre ses propriétés et ses réactions, ainsi que pour calculer sa masse molaire et d’autres propriétés physico-chimiques.
