Le NH4OH ou hydroxyde d’ammonium est une solution claire et incolore communément appelée ammoniaque domestique. C’est une solution fortement alcaline avec un pH de 11-12. Il est utilisé comme agent de nettoyage, dans la production d’engrais et dans certaines applications alimentaires comme agent levant.
| Nom UICPA | L’hydroxyde d’ammonium |
| Formule moléculaire | NH4OH |
| Numero CAS | 1336-21-6 |
| Synonymes | Solution d’ammoniaque, ammoniaque aqueuse, ammoniaque domestique |
| InChI | InChI=1S/H5NO/c1-5(2,3)4/h(H,1,2,3,4)/p+1 |
Propriétés de l’hydroxyde d’ammonium
Formule d’hydroxyde d’ammonium
La formule chimique de l’hydroxyde d’ammonium est NH4OH. La formule représente le nombre relatif et les types d’atomes dans le composé. Le « N » représente l’azote, « H » représente l’hydrogène et « O » représente l’oxygène. Les numéros d’indice dans la formule indiquent le nombre d’atomes de chaque élément du composé. Dans le cas de l’hydroxyde d’ammonium, il y a un atome d’azote, quatre atomes d’hydrogène et un atome d’oxygène. La formule de l’hydroxyde d’ammonium représente le composé ionique, qui est composé d’ions ammonium chargés positivement (NH4+) et d’ions hydroxyde chargés négativement (OH-).
Hydroxyde d’ammonium Ph
Le pH de l’hydroxyde d’ammonium (NH4OH) est basique, avec une valeur d’environ 11. Cela signifie que l’hydroxyde d’ammonium a une concentration élevée en ions hydroxyde (OH-) et est très alcalin. Le pH des solutions d’hydroxyde d’ammonium peut varier en fonction de la concentration, de la température et d’autres facteurs, mais il est généralement considéré comme une base forte avec un pH supérieur à 7,0. L’hydroxyde d’ammonium est couramment utilisé dans diverses applications industrielles et domestiques, telles que le nettoyage et l’ajustement du pH, en raison de sa forte alcalinité. Cependant, il est important de manipuler l’hydroxyde d’ammonium avec prudence, car il peut être corrosif et dangereux s’il n’est pas manipulé correctement.
Hydroxyde d’ammonium FDS
MSDS signifie Material Safety Data Sheet, qui est un document qui fournit des informations sur les propriétés, la manipulation, le stockage et l’élimination d’une substance chimique. Une fiche signalétique pour l’hydroxyde d’ammonium (NH4OH) fournirait des informations sur ses propriétés physiques et chimiques, ses effets potentiels sur la santé, les risques d’incendie et d’explosion, ainsi que toutes les mesures de protection qui devraient être prises lors de la manipulation ou de l’utilisation de la substance.
La fiche signalétique de l’hydroxyde d’ammonium comprendrait également des informations sur sa toxicité, sa réactivité et son inflammabilité, ainsi que toutes les mesures de premiers secours appropriées en cas d’exposition. De plus, la fiche signalétique fournirait des informations sur le stockage et l’élimination appropriés de l’hydroxyde d’ammonium, y compris toutes les précautions nécessaires pour éviter les déversements ou les fuites.
Solubilité de l’hydroxyde d’ammonium
L’hydroxyde d’ammonium (NH4OH) est très soluble dans l’eau. Il forme une solution claire, incolore et hautement alcaline avec une odeur caractéristique. La solubilité de l’hydroxyde d’ammonium dans l’eau dépend de la température et de la concentration, des températures et des concentrations plus élevées entraînant une solubilité accrue.
En général, l’hydroxyde d’ammonium se dissout facilement dans l’eau, produisant une solution neutre à alcaline avec un pH d’environ 9 à 11. La solubilité de l’hydroxyde d’ammonium dans l’eau est également influencée par d’autres facteurs tels que la pression, la température et la présence d’autres facteurs. substances dissoutes.
Hydroxyde D’Ammonium Masse molaire
La masse molaire de l’hydroxyde d’ammonium (NH4OH) est de 35,05 g/mol. Cette valeur est importante pour déterminer la quantité d’hydroxyde d’ammonium dans un échantillon, ainsi que pour les réactions chimiques impliquant le composé. Pour déterminer la masse molaire d’une substance, les poids atomiques de tous les éléments du composé sont additionnés. Dans le cas de l’hydroxyde d’ammonium, la masse molaire est calculée en additionnant les poids atomiques de l’azote (14,01 g/mol), de l’hydrogène (1,01 g/mol) et de l’oxygène (16,00 g/mol).
Point d’ébullition de l’hydroxyde d’ammonium
Le point d’ébullition de l’hydroxyde d’ammonium est d’environ 38°C. Cette valeur est importante pour déterminer les conditions dans lesquelles le composé passera d’un liquide à un gaz. Trouvez le point d’ébullition de l’hydroxyde d’ammonium en mesurant la pression de vapeur de la substance. La pression de vapeur est la pression exercée par la vapeur au-dessus du liquide dans un récipient fermé. Gardez à l’esprit que le point d’ébullition peut également changer en fonction de la pression et de la température.
Point de fusion de l’hydroxyde d’ammonium
Le point de fusion de l’hydroxyde d’ammonium est de -77°C. Cette valeur est importante pour déterminer les conditions dans lesquelles le composé passera d’un solide à un liquide. Mesurez le point de fusion de l’hydroxyde d’ammonium en évaluant la force de ses liaisons intermoléculaires. N’oubliez pas que le point de fusion peut varier en fonction de la pression et de la température du milieu environnant.
Densité d’hydroxyde d’ammonium g/ml
La densité de l’hydroxyde d’ammonium est d’environ 0,91 g/mL. Cette valeur est importante pour déterminer la quantité d’hydroxyde d’ammonium dans un volume donné, ainsi que pour calculer la masse de la substance dans un volume donné. Déterminez la densité de l’hydroxyde d’ammonium en divisant sa masse par le volume qu’il occupe. Gardez à l’esprit que la densité d’une substance peut changer en fonction de la température et de la pression.
Hydroxyde d’ammonium Poids moléculaire
Le poids moléculaire de l’hydroxyde d’ammonium est de 35,05 g/mol. Cette valeur est importante pour déterminer la quantité d’hydroxyde d’ammonium dans un échantillon, ainsi que pour les réactions chimiques impliquant le composé. Calculez le poids moléculaire de l’hydroxyde d’ammonium en ajoutant les poids atomiques de l’azote (14,01 g/mol), de l’hydrogène (1,01 g/mol) et de l’oxygène (16,00 g/mol).
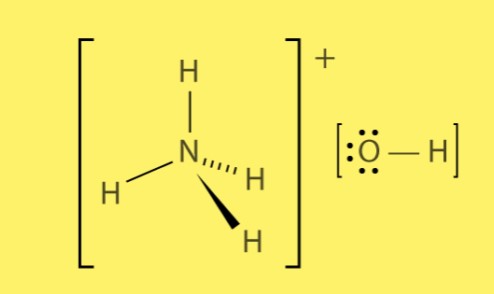
Structure de l’hydroxyde d’ammonium
L’hydroxyde d’ammonium se forme à partir de la combinaison d’ions ammonium chargés positivement (NH4+) et d’ions hydroxyde chargés négativement (OH-). Les liaisons ioniques entre ces ions créent une forte attraction électrostatique, conduisant à la formation du composé.
| Apparence | Liquide clair et incolore |
| Gravité spécifique | 0,91 g/ml |
| Couleur | Incolore |
| Odeur | Odeur âcre, semblable à celle de l’ammoniaque |
| Masse molaire | 35,05 g/mole |
| Densité | 0,91 g/ml |
| Point de fusion | -77°C |
| Point d’ébullition | 38°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Complètement soluble |
| Solubilité | Soluble dans l’éthanol et le méthanol |
| La pression de vapeur | 17,5 mmHg à 20°C |
| Densité de vapeur | 0,6 (air = 1) |
| pKa | 10.64 |
| pH | 11,6 (solution 1 M) |
Sécurité et dangers de l’hydroxyde d’ammonium
L’hydroxyde d’ammonium est une solution fortement alcaline et peut être dangereuse si elle est mal manipulée. Il peut provoquer une irritation de la peau et des yeux, ainsi que des problèmes respiratoires en cas d’inhalation. En cas de contact avec la peau, rincer abondamment à l’eau et consulter un médecin si nécessaire. En cas d’ingestion, il peut causer des dommages graves, voire la mort. Il est donc important de le garder hors de portée des enfants et des animaux domestiques. Il est également inflammable et doit être conservé à l’écart des sources de chaleur et des flammes. Lors de l’utilisation d’hydroxyde d’ammonium, il est important de porter des équipements de protection tels que des gants et des lunettes de protection. En cas de déversement, neutraliser avec un acide et nettoyer avec une ventilation adéquate. Le respect des précautions de sécurité et un stockage approprié sont essentiels lors de la manipulation de l’hydroxyde d’ammonium.
| Symboles de danger | Corrosif |
| Description de la sécurité | S26, S37/39 |
| Numéros d’identification de l’ONU | UN2672 |
| Code SH | 2814.10.00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Nocif en cas d’ingestion, d’inhalation ou de contact avec la peau. Peut provoquer de graves irritations et brûlures. |
Méthodes de synthèse de l’hydroxyde d’ammonium
L’hydroxyde d’ammonium peut être synthétisé par deux méthodes principales : le procédé au chlorure d’ammonium et le procédé à l’ammoniac.
Le procédé au chlorure d’ammonium implique la réaction du gaz ammoniac et de l’acide chlorhydrique, produisant du chlorure d’ammonium et de l’eau :
NH3 + HCl → NH4Cl + H2O
Le chlorure d’ammonium est ensuite dissous dans l’eau pour produire une solution d’hydroxyde d’ammonium. Cette solution peut être davantage concentrée par distillation pour produire une solution concentrée d’hydroxyde d’ammonium.
Le procédé à l’ammoniac implique la réaction directe du gaz ammoniac et de l’eau, produisant de l’hydroxyde d’ammonium et de l’hydrogène gazeux :
NH3 + H2O → NH4OH + H2
La production d’hydroxyde d’ammonium peut être contrôlée en ajustant la température et la pression pendant la réaction exothermique, ce qui donne une solution qui peut être purifiée et concentrée grâce à des techniques de lavage et de distillation. La production industrielle d’hydroxyde d’ammonium utilise couramment le procédé à l’ammoniac en raison de sa simplicité et de son efficacité, mais le procédé au chlorure d’ammonium sert d’option de secours en cas de pénurie d’ammoniac.
Utilisations de l’hydroxyde d’ammonium
L’hydroxyde d’ammonium a de nombreuses utilisations dans différentes industries. Certaines de ses applications courantes sont :
- Dans diverses applications domestiques et industrielles, l’hydroxyde d’ammonium est utilisé comme agent nettoyant pour éliminer efficacement la graisse, les huiles et la saleté des surfaces.
- Dans l’industrie alimentaire, il sert de désinfectant pour tuer les bactéries et les agents pathogènes sur les surfaces en contact avec les aliments. En agriculture, l’hydroxyde d’ammonium fournit de l’azote essentiel comme engrais pour la croissance des plantes et constitue un ingrédient clé dans la production d’engrais au nitrate d’ammonium.
- Dans l’industrie pharmaceutique, il est utilisé dans la production de certains médicaments et comme ajusteur de pH dans la fabrication de certains produits médicaux.
- L’industrie de la boulangerie utilise l’hydroxyde d’ammonium comme agent levant pour faire lever la pâte, et il fonctionne également comme agent aromatisant dans certains produits alimentaires et comme ajusteur de pH dans la production de certains aliments et boissons.
- Dans l’industrie textile, l’hydroxyde d’ammonium neutralise les acides et ajuste les niveaux de pH dans la production textile. Dans le traitement de l’eau, il ajuste les niveaux de pH et élimine les impuretés.
Dans l’ensemble, l’hydroxyde d’ammonium est un produit chimique polyvalent et largement utilisé, avec des applications dans diverses industries. Cependant, il est important de manipuler l’hydroxyde d’ammonium en toute sécurité, car il peut être dangereux s’il n’est pas manipulé correctement.
Des questions:
L’hydroxyde d’ammonium est-il soluble ?
Oui, l’hydroxyde d’ammonium est très soluble dans l’eau. Il forme une solution claire, incolore et hautement alcaline avec une odeur caractéristique. La solubilité de l’hydroxyde d’ammonium dans l’eau dépend de la température et de la concentration, des températures et des concentrations plus élevées entraînant une solubilité accrue.
Quelle est la formule chimique de l’hydroxyde d’ammonium ?
La formule chimique de l’hydroxyde d’ammonium est NH4OH.
Quelle est la formule de l’hydroxyde d’ammonium ?
La formule de l’hydroxyde d’ammonium est NH4OH.
L’hydroxyde d’ammonium est-il une base forte ?
Oui, l’hydroxyde d’ammonium est considéré comme une base forte. Il se dissocie complètement dans l’eau pour former des ions hydroxyde (OH-) et des ions ammonium (NH4+), ce qui le rend très alcalin avec un pH d’environ 11. Cette alcalinité élevée en fait un produit chimique utile dans diverses applications industrielles et domestiques, telles que comme nettoyage et ajustement du pH. Cependant, il est important de manipuler l’hydroxyde d’ammonium avec précaution, car il peut être corrosif et dangereux s’il n’est pas manipulé correctement.
nom du composé nh4oh
Le nom du composé chimique du NH4OH est l’hydroxyde d’ammonium.
nom nh4oh
Le nom du NH4OH est hydroxyde d’ammonium.
