L’hydrosulfite de sodium (Na2S2O4) est une poudre cristalline blanche utilisée comme agent réducteur dans diverses industries telles que le textile et le papier. Il enlève la couleur des tissus et de la pâte à papier.
| Nom UICPA | Dithionite de sodium |
| Formule moléculaire | Na2S2O4 |
| Numero CAS | 7775-14-6 |
| Synonymes | Hyposulfite de sodium, dithionate de sodium, sulfoxylate de sodium, hydrogénosulfite de sodium |
| InChI | InChI=1S/2Na.H2O4S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriétés de l’hydrosulfite de sodium
Formule d’hydrosulfite de sodium
La formule chimique de l’hydrosulfite de sodium est Na2S2O4. Cela signifie que chaque molécule d’hydrosulfite de sodium contient deux atomes de sodium, deux atomes de soufre et quatre atomes d’oxygène. La formule indique que le composé est constitué d’ions sodium chargés positivement et d’ions sulfite chargés négativement.
Hydrosulfite De Sodium Masse molaire
La masse molaire de Na2S2O4 est de 174,11 g/mol. Cette valeur est calculée en additionnant les masses atomiques des éléments présents dans une molécule de Na2S2O4. La masse molaire est un paramètre important en stœchiométrie et est utilisée pour calculer la quantité de substance dans un échantillon donné du composé.
Point d’ébullition de l’hydrosulfite de sodium
Na2S2O4 est un composé stable et n’a pas de point d’ébullition. Au lieu de cela, il se décompose lorsqu’il est chauffé au-dessus de 150 °C pour libérer du dioxyde de soufre et de la vapeur d’eau. La réaction de décomposition est exothermique et des précautions doivent être prises lors du chauffage du Na2S2O4.
Hydrosulfite de sodium Point de fusion
Le point de fusion du Na2S2O4 est de 300°C. A cette température, le composé solide fond pour former un liquide incolore. Le point de fusion est un paramètre important pour déterminer la stabilité du composé et son adéquation à différentes applications.
Densité d’hydrosulfite de sodium g/ml
La densité de Na2S2O4 est de 1,48 g/ml. Cette valeur indique que Na2S2O4 est un composé relativement dense par rapport à l’eau. La densité est un paramètre important pour déterminer la solubilité du composé et sa capacité à se mélanger avec d’autres substances.
Hydrosulfite De Sodium Poids moléculaire
Le poids moléculaire de Na2S2O4 est de 174,11 g/mol. Cette valeur est calculée en additionnant les masses atomiques des éléments présents dans une molécule de Na2S2O4. Le poids moléculaire est un paramètre important pour déterminer la quantité de substance dans un échantillon donné du composé.
Structure de l’hydrosulfite de sodium
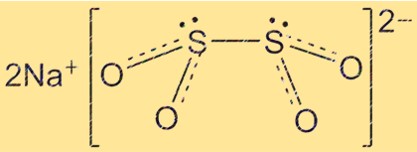
La structure de Na2S2O4 est tétraédrique, avec les atomes de soufre situés aux coins du tétraèdre et les atomes d’oxygène formant les bords. Les ions sodium sont situés au centre du tétraèdre. La structure du Na2S2O4 est importante pour comprendre ses propriétés chimiques et physiques.
Solubilité de l’hydrosulfite de sodium
Na2S2O4 est hautement soluble dans l’eau, avec une solubilité de 58 g/100 mL à 20°C. La solubilité est affectée par la température et le pH, une solubilité plus élevée étant observée à des températures plus élevées et à des valeurs de pH plus faibles. La haute solubilité du Na2S2O4 le rend utile dans diverses applications telles que les industries textiles et papetières où il est utilisé comme agent réducteur.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,48 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 174,11 g/mole |
| Densité | 1,48 g/ml |
| Point de fusion | 300 °C |
| Point d’ébullition | Se décompose à 150 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, le glycérol, l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 6.6 |
| pH | 7-8 (solution à 1%) |
Sécurité et dangers de l’hydrosulfite de sodium
Le Na2S2O4 est généralement sans danger lorsqu’il est manipulé et utilisé correctement, mais il peut présenter certains dangers s’il est mal manipulé ou utilisé de manière inappropriée. Il est classé comme substance dangereuse et peut provoquer une irritation de la peau et des yeux s’il entre en contact avec ces parties du corps. L’inhalation de poussière ou de brouillard de Na2S2O4 peut également irriter le système respiratoire. Na2S2O4 est également un agent réducteur, ce qui signifie qu’il peut réagir avec d’autres produits chimiques et produire des gaz inflammables ou explosifs. Des mesures de sécurité appropriées, telles que le port d’un équipement de protection et la manipulation de la substance dans des zones bien ventilées, doivent être respectées pour éviter les accidents et les blessures.
| Symboles de danger | XI, C |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Ne pas inhaler la poussière ou le brouillard. Portez un équipement de protection. Manipuler dans des endroits bien ventilés. |
| Numéros d’identification de l’ONU | UN1384 |
| Code SH | 28311000 |
| Classe de danger | 4.2 |
| Groupe d’emballage | III |
| Toxicité | DL50 : 1 520 mg/kg (orale, rat) ; CL50 : 1840 ppm/4h (inhalation, rat) |
Méthodes de synthèse de l’hydrosulfite de sodium
Plusieurs méthodes permettent de synthétiser Na2S2O4, mais les plus courantes impliquent la réaction du bisulfite de sodium et du dithionite de sodium.
Une méthode consiste à ajouter du bisulfite de sodium à une solution d’ hydroxyde de sodium et de dithionite de sodium, tandis qu’une autre méthode consiste à chauffer un mélange de bisulfite de sodium et de dithionite de sodium.
La formation de Na2S2O4 produit une poudre cristalline blanche que l’on peut collecter et purifier selon les deux méthodes.
Une autre méthode de synthèse de Na2S2O4 implique la réaction entre le dioxyde de soufre et le borohydrure de sodium . La réaction produit du Na2S2O4 ainsi que du borate de sodium et de l’hydrogène gazeux. Cette méthode est généralement moins courante que les méthodes au bisulfite de sodium et au dithionite de sodium.
Utilisations de l’hydrosulfite de sodium
Na2S2O4 a diverses utilisations dans différentes industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Industrie textile : Utilisé comme agent réducteur dans l’industrie textile pour éliminer les excès de teinture et de blanchiment des tissus.
- Industrie du papier : Utilisé dans l’industrie du papier pour blanchir la pâte de bois et les produits en papier.
- Industrie alimentaire : Utilisé comme additif alimentaire pour prévenir la décoloration et comme conservateur dans les fruits et légumes en conserve.
- Traitement de l’eau : Utilisé pour éliminer l’excès de chlore dans le traitement de l’eau potable et des eaux usées.
- Industrie minière : Utilisé dans l’industrie minière pour séparer les minerais de cuivre et de molybdène.
- Industrie des polymères : Utilisé dans l’industrie des polymères pour réduire la couleur des polymères et des plastiques.
- Industrie de la photographie : utilisé dans l’industrie de la photographie comme fixateur photographique pour éliminer les halogénures d’argent non exposés des tirages photographiques.
- Autres applications industrielles : Utilisé dans diverses autres industries, telles que la transformation du cuir, le forage pétrolier et comme agent réducteur dans les réactions de synthèse chimique.
Des questions:
Q : Quel nettoyant contient de l’hydrosulfite de sodium ?
R : Le Na2S2O4 est couramment utilisé dans les nettoyants ménagers pour éliminer les taches et comme alternative à l’eau de Javel.
Q : Quelle est la fonction de l’hydrosulfite de sodium dans la réaction avec l’indigo ?
R : Na2S2O4 agit comme un agent réducteur dans la réaction avec l’indigo, qui convertit le colorant bleu indigo insoluble en un composé soluble et incolore.
Q : Où acheter de l’hydrosulfite de sodium ?
R : Na2S2O4 peut être acheté auprès de fournisseurs de produits chimiques, tels que Sigma-Aldrich, Fisher Scientific et VWR International.
Q : Comment neutraliser l’hydrosulfite de sodium ?
R : Na2S2O4 peut être neutralisé avec de l’hydroxyde de sodium ou une autre base forte.
Q : Quels aliments indiens utilisent de l’hydrosulfite de sodium ?
R : Le Na2S2O4 n’est pas couramment utilisé dans les aliments indiens.
Q : Comment l’hydrosulfite de sodium blanchit-il ?
R : Na2S2O4 agit comme un agent réducteur et détruit les liaisons chimiques qui donnent de la couleur au matériau, éliminant ainsi la couleur et entraînant un blanchiment.
Q : Quelle est la fonction de l’hydrosulfite de sodium dans la réaction avec l’indigo ?
R : Na2S2O4 agit comme un agent réducteur dans la réaction avec l’indigo, qui convertit le colorant bleu indigo insoluble en un composé soluble et incolore.
Q : Qu’est-ce qui produit une odeur lors de l’ajout d’hydrosulfite de sodium ?
R : Lors de l’ajout de Na2S2O4, cela peut produire une odeur de soufre en raison de la libération de dioxyde de soufre gazeux.
Q : L’hydrosulfite de sodium dihydraté est-il un agent réducteur ?
R : Oui, le Na2S2O4 dihydraté est un puissant agent réducteur couramment utilisé dans les processus industriels.
