L’heptane est un liquide incolore et inflammable couramment utilisé comme solvant. Il a une formule moléculaire de C7H16 et se trouve dans l’essence. L’heptane possède sept atomes de carbone et 16 atomes d’hydrogène.
| Nom UICPA | Heptane |
| Formule moléculaire | C7H16 |
| Numero CAS | 142-82-5 |
| Synonymes | n-heptane, dipropylméthane, hydrure d’heptyle, etc. |
| InChI | InChI=1S/C7H16/c1-3-5-7-6-4-2/h3-7H2,1-2H3 |
Propriétés de l’heptane
Formule heptane
La formule chimique de l’heptane est C7H16. Il se compose de sept atomes de carbone et de 16 atomes d’hydrogène, disposés en chaîne droite. La structure à chaîne droite de l’heptane en fait un membre important de la famille des hydrocarbures alcanes.
Heptane Masse molaire
La masse molaire du C7H16 est de 100,20 g/mol. Cette valeur est calculée en additionnant les masses atomiques de tous les atomes présents dans une seule molécule de C7H16. La masse molaire du C7H16 est un paramètre important dans de nombreux calculs chimiques, notamment la stœchiométrie, la thermodynamique et la cinétique.
Point d’ébullition de l’heptane
Le C7H16 a un point d’ébullition de 98,42°C (209,16°F). Ce point d’ébullition relativement bas en fait un solvant utile pour diverses applications, comme en laboratoire et dans la production d’essence. Le point d’ébullition du C7H16 est influencé par plusieurs facteurs, notamment l’intensité des forces intermoléculaires et le poids moléculaire du composé.
Heptane Point de fusion
Le point de fusion du C7H16 est de -91°C (-132°F). Ce point de fusion bas indique que le C7H16 est un liquide à température ambiante et est très volatil. Le faible point de fusion du C7H16 est dû aux faibles forces de Van der Waals entre ses molécules.
Heptane Densité g/mL
La densité du C7H16 est de 0,684 g/mL à 20°C (68°F). La densité du C7H16 est une mesure de la quantité de masse présente dans un volume donné. Cette valeur est affectée par des facteurs tels que la température, la pression et la pureté de l’échantillon.
Heptane Poids moléculaire
Le poids moléculaire du C7H16 est de 100,20 g/mol. Cette valeur est calculée en additionnant les masses atomiques de tous les atomes présents dans une seule molécule de C7H16. Le poids moléculaire du C7H16 est un paramètre crucial dans de nombreuses réactions chimiques, car il permet de déterminer la quantité de réactifs et de produits présents dans un mélange réactionnel.
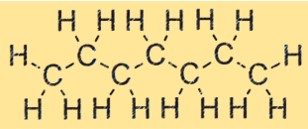
Structure de l’heptane
C7H16 a une structure à chaîne droite, avec sept atomes de carbone et 16 atomes d’hydrogène disposés de manière linéaire. Cette structure est une caractéristique des alcanes, une famille d’hydrocarbures. La structure du C7H16 influence ses propriétés physiques et chimiques, notamment son point d’ébullition, son point de fusion et sa réactivité.
Solubilité de l’heptane
Le C7H16 est une molécule apolaire et peu soluble dans les solvants polaires comme l’eau. Cependant, le C7H16 est hautement soluble dans les solvants non polaires tels que l’hexane, le benzène et le toluène. Ce comportement de solubilité est dû au fait que le semblable se dissout : les molécules non polaires ont tendance à se dissoudre dans les solvants non polaires, tandis que les molécules polaires ont tendance à se dissoudre dans les solvants polaires.
| Apparence | Liquide incolore |
| Densité spécifique à 25°C | 0,684 g/ml |
| Couleur | Incolore |
| Odeur | Odeur d’essence |
| Masse molaire | 100,20 g/mole |
| Densité à 25°C | 0,684 g/ml |
| Point de fusion | -91°C (-132°F) |
| Point d’ébullition | 98,42°C (209,16°F) |
| Point d’éclair | -4°C (25°F) |
| Solubilité dans l’eau à 25°C | 0,004 g/100 ml |
| Solubilité dans d’autres solvants | Très soluble dans les solvants apolaires (hexane, toluène, benzène) |
| Pression de vapeur à 20°C | 25,31 mmHg |
| Densité de vapeur à 20°C | 3,46 (air = 1) |
| pKa | 50 (estimé) |
| pH | N’est pas applicable |
Sécurité et dangers de l’heptane
Le C7H16 présente plusieurs risques pour la sécurité, principalement en raison de sa nature hautement inflammable. Il peut facilement prendre feu et libérer des vapeurs inflammables lorsqu’il est exposé à la chaleur ou aux flammes. Les vapeurs de C7H16 peuvent également irriter les yeux, la peau et le système respiratoire, provoquant de la toux, une respiration sifflante et un essoufflement. De plus, le C7H16 peut être nocif en cas d’ingestion, provoquant des nausées, des vomissements et des douleurs abdominales. Par conséquent, des précautions appropriées doivent être prises lors de la manipulation du C7H16, comme utiliser un équipement de protection approprié, assurer une bonne ventilation dans l’espace de travail et le tenir à l’écart des sources de chaleur et des flammes nues. Il est également essentiel de suivre des protocoles appropriés de stockage, de manipulation et d’élimination du C7H16 afin de minimiser tout risque potentiel.
| Symboles de danger | F, Xi |
| Description de la sécurité | Liquide et vapeurs hautement inflammables. Provoque une irritation cutanée. |
| Numéros d’identification de l’ONU | ONU 1206 |
| Code SH | 2902.41.000 |
| Classe de danger | 3 (Liquides inflammables) |
| Groupe d’emballage | II |
| Toxicité | Peut être nocif en cas d’ingestion et peut provoquer une irritation de la peau et des yeux |
Méthodes de synthèse de l’heptane
Il existe diverses méthodes pour synthétiser le C7H16, mais la méthode principale consiste à distiller de manière fractionnée du pétrole ou du pétrole brut. Cette méthode sépare les hydrocarbures en fonction de leur point d’ébullition, et la distillation de la partie du mélange qui bout à une température comprise entre 90 et 100°C donne du C7H16.
Une autre méthode de synthèse du C7H16 consiste à hydrogéner catalytiquement de l’hexène ou d’autres oléfines à l’aide d’un catalyseur au palladium à des températures et des pressions élevées.
En utilisant le procédé Fischer-Tropsch, on peut synthétiser le C7H16 en faisant réagir du monoxyde de carbone et de l’hydrogène gazeux sur un catalyseur au fer ou au cobalt à des températures et des pressions élevées. Ce procédé produit un mélange d’hydrocarbures, dont C7H16, qui peuvent être séparés par distillation fractionnée.
Pour synthétiser le C7H16, on peut utiliser un catalyseur au platine à hautes températures et pressions pour déshydrocycliser le méthylcyclohexane. De plus, la combinaison d’hydrocarbures plus petits obtenus par craquage du naphta ou d’autres fractions pétrolières peut produire du C7H16.
Dans l’ensemble, la synthèse du C7H16 implique diverses méthodes, utilisant principalement du pétrole ou du pétrole brut comme matière première, et implique diverses réactions chimiques telles que la distillation, l’hydrogénation et la déshydrocyclisation.
Utilisations de l’heptane
Le C7H16 a plusieurs applications industrielles et commerciales, notamment :
- Solvant : Couramment utilisé comme solvant dans diverses industries, telles que la fabrication du pétrole et du gaz, du caoutchouc et des adhésifs. Dissout une large gamme de composés, notamment les graisses, les huiles et les résines.
- Carburant : Utilisé comme carburant de référence pour les moteurs à essence. Couramment utilisé dans les laboratoires de recherche pour les tests et le développement de moteurs.
- Extraction : Utilisé comme solvant d’extraction pour les produits naturels, tels que les huiles végétales, les extraits de plantes et les huiles essentielles.
- Nettoyage : Utilisé comme agent de nettoyage dans l’industrie électronique. Utilisé pour éliminer les contaminants des composants électroniques.
- Réactif de laboratoire : utilisé comme réactif dans diverses procédures de laboratoire, notamment l’extraction d’ADN, la chromatographie et la spectroscopie.
- Diluant à peinture : utilisé comme diluant à peinture pour diluer les peintures à base d’huile et pour nettoyer le matériel de peinture.
- Adhésif : Utilisé comme adhésif dans diverses applications, telles que le laminage, le collage et le scellement.
Des questions:
Q : Quelle est la valeur de n dans ch3(ch2)nch3 si le nom de l’hydrocarbure est heptane ?
R : La valeur de n dans ch3(ch2)nch3 pour l’heptane est 5.
Q : L’heptane est-il soluble dans l’eau ?
R : Non, le C7H16 n’est pas soluble dans l’eau car il s’agit d’un hydrocarbure non polaire et l’eau est une molécule polaire.
Q : L’heptane est-il polaire ?
R : Non, le C7H16 est un hydrocarbure non polaire en raison de sa structure moléculaire symétrique et du partage égal des électrons entre les atomes de carbone et d’hydrogène.
Q : Qu’est-ce que l’heptane ?
R : C7H16 est un hydrocarbure alcane à chaîne droite de formule chimique C7H16. C’est un liquide incolore à l’odeur caractéristique et est couramment utilisé comme carburant de référence pour les moteurs à essence.
Q : Quel est le nom de cet hydrocarbure ? C7H16
R : Le nom de cet hydrocarbure est C7H16.
Q : Combien d’isomères d’heptane ?
R : C7H16 possède neuf isomères possibles, y compris des isomères à chaîne droite et à chaîne ramifiée.
Q : L’heptane est-il volatil ?
R : Oui, le C7H16 est un liquide volatil avec un point d’ébullition bas de 98,4 °C et une pression de vapeur élevée.
Q : Quelle est la formule moléculaire de l’heptane ?
R : La formule moléculaire de l’heptane est C7H16.
Q : Quel est l’hexane ou l’heptane le plus polaire ?
R : L’hexane et le C7H16 sont tous deux des hydrocarbures non polaires, mais le C7H16 est légèrement plus polaire que l’hexane en raison de sa plus grande taille moléculaire et de ses plus grandes forces de dispersion de Londres.
Q : L’heptane est-il couvert par le PSM ?
R : Oui, le C7H16 est une substance couverte par la réglementation sur la gestion de la sécurité des processus (PSM), qui s’applique aux installations qui manipulent, utilisent ou stockent une quantité supérieure à un seuil de certains produits chimiques dangereux.
