L’acide formique ou HCOOH est un liquide incolore avec une odeur âcre. Il est largement utilisé comme agent de conservation et antibactérien et dans la fabrication du cuir, des textiles et du caoutchouc.
| Nom UICPA | Acide méthanoïque |
| Formule moléculaire | HCOOH |
| Numero CAS | 64-18-6 |
| Synonymes | Acide hydrogène carboxylique, acide formylique, acide aminé, acide formylique, acide métacarbonoïque, acide thionyl formique, etc. |
| InChI | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
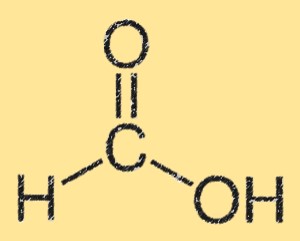
Structure de l’acide formique
La structure de l’acide formique est caractérisée par un groupe acide carboxylique (-COOH) attaché à un seul atome de carbone. L’atome de carbone est également lié à un atome d’hydrogène et à un atome d’oxygène. La structure de l’acide formique est plane et présente des liaisons hydrogène entre les groupes acide carboxylique. La liaison hydrogène donne lieu à sa haute solubilité dans l’eau.
Formule d’acide formique
La formule chimique de l’acide formique est HCOOH. C’est un composé organique simple qui contient un atome de carbone, un atome d’oxygène et deux atomes d’hydrogène. La formule de l’acide formique est importante pour déterminer ses propriétés chimiques et physiques, ainsi que son comportement dans différentes conditions. Il est également utilisé dans divers calculs chimiques, tels que la stœchiométrie et la molarité.
Structure de Lewis HCOOH
La structure de Lewis de l’acide formique (HCOOH) est la suivante :
H
|
C = O
|
OH
L’atome de carbone est au centre de la structure avec quatre électrons de valence. Il forme des liaisons simples avec les deux atomes d’hydrogène et l’atome d’oxygène, qui possède deux paires d’électrons libres. L’atome d’oxygène forme également une double liaison avec l’autre atome de carbone, qui porte une paire d’électrons libres. La structure de Lewis montre que la molécule possède une liaison covalente polaire en raison de la différence d’électronégativité entre les atomes de carbone et d’oxygène.
Acide Formique Masse molaire
La masse molaire de l’acide formique, également appelé acide méthanoïque, est de 46,03 g/mol. Sa formule chimique est HCOOH, ce qui indique qu’il contient un atome de carbone, un oxygène et deux atomes d’hydrogène. La masse molaire est un paramètre important pour déterminer la quantité d’une substance nécessaire pour préparer une solution d’une concentration spécifique. Par exemple, pour préparer une solution 1 M d’acide formique, il faudrait dissoudre 46,03 g d’acide formique dans 1 litre de solvant.
Point d’ébullition de l’acide formique
Le point d’ébullition de HCOOH est de 100,8 °C (213,4 °F). C’est un liquide incolore qui a une odeur âcre et qui est très soluble dans l’eau. Le point d’ébullition du HCOOH est relativement bas, ce qui signifie qu’il peut être facilement vaporisé et distillé. Cette propriété le rend utile dans diverses applications industrielles, telles que la production de colorants, de plastiques et de produits pharmaceutiques.
HCOOH Point de fusion
Le point de fusion de HCOOH est de 8,4 °C (47,1 °F). C’est un solide à température ambiante et il peut être obtenu sous sa forme pure en le refroidissant en dessous de son point de fusion. Les cristaux HCOOH sont blancs et dégagent une odeur piquante. Le point de fusion du HCOOH est relativement bas par rapport aux autres acides carboxyliques, ce qui en fait un solvant utile pour certaines réactions chimiques.
HCOOH Densité g/mL
La densité de HCOOH est de 1,220 g/mL à 25 °C (77 °F). Il est plus dense que l’eau, qui a une densité de 1 000 g/mL à la même température. La densité de HCOOH est une propriété importante qui détermine sa solubilité dans l’eau et d’autres solvants. Cela affecte également son comportement dans différentes conditions, telles que la température et la pression.
Poids moléculaire de l’acide formique
Le poids moléculaire de l’acide formique est de 46,03 g/mol. C’est un composé organique simple dont la formule chimique est HCOOH. Le poids moléculaire est un paramètre important pour déterminer les propriétés physiques et chimiques d’une substance. Il est utilisé pour calculer diverses quantités, telles que le nombre de moles, la masse et le volume d’une substance.
| Apparence | Liquide incolore |
| Gravité spécifique | 1.22 |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 46,03 g/mole |
| Densité | 1,220 g/ml |
| Point de fusion | 8,4 °C |
| Point d’ébullition | 100,8 °C |
| Point d’éclair | 68 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans la plupart des solvants organiques |
| Pression de vapeur | 44,5 mmHg |
| Densité de vapeur | 1,5 (air=1) |
| pKa | 3,75 |
| pH | 2.4 |
Sécurité et dangers de l’acide formique
HCOOH présente plusieurs risques de sécurité et de danger. Il s’agit d’une substance hautement corrosive et toxique qui peut provoquer de graves brûlures de la peau et des lésions oculaires au contact. L’inhalation de vapeurs de HCOOH peut entraîner une irritation respiratoire et des lésions pulmonaires. Il est également inflammable et peut s’enflammer à des températures élevées, présentant un risque d’incendie. Des précautions de sécurité appropriées doivent être prises lors de la manipulation du HCOOH, y compris l’utilisation de vêtements de protection, de gants et de lunettes de protection. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matières incompatibles, telles que les agents oxydants et les alcalis.
| Symboles de danger | Corrosif, Toxique |
| Description de la sécurité | Porter des gants de protection et une protection pour les yeux/le visage. En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. |
| Numéros d’identification de l’ONU | UN1779 |
| Code SH | 2915.11.00 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | II (Intermédiaire) |
| Toxicité | DL50 1,8 g/kg (orale, rat) |
Méthodes de synthèse de l’acide formique
L’acide formique peut être synthétisé par diverses méthodes.
- Une méthode courante implique la réaction du monoxyde de carbone et de l’eau en présence d’un catalyseur, tel que le rhodium ou le cobalt. Il s’agit du processus Formox. Ce processus produit de l’acide formique et de l’hydrogène gazeux.
- Une autre méthode implique l’oxydation du formaldéhyde à l’aide d’un agent oxydant puissant, tel que l’acide chromique ou le permanganate de potassium, dans des conditions acides. Cette réaction produit de l’acide formique et de l’eau.
- Une façon de synthétiser l’acide formique consiste à faire réagir le formiate de sodium avec de l’acide sulfurique. Cette réaction entraîne la formation d’acide formique et de sulfate de sodium comme sous-produit.
- Les fourmis produisent de l’acide formique comme mécanisme de défense naturel, et il peut être obtenu à partir de leur corps par distillation.
- Une autre méthode de synthèse de HCOOH consiste à faire réagir du dioxyde de carbone avec de l’hydrogène en présence d’un catalyseur, tel que la chromite de cuivre ou l’oxyde de zinc. Ce processus, connu sous le nom de réaction de synthèse de HCOOH, produit du HCOOH et de l’eau.
- Le HCOOH peut également être obtenu à partir de sources naturelles, telles que les feuilles d’ortie, où il est présent en petites quantités.
Globalement, il existe plusieurs méthodes disponibles pour la synthèse de HCOOH, chacune ayant ses avantages et ses inconvénients.
Utilisations de l’acide formique
L’acide formique a un large éventail d’applications dans diverses industries.
- Sa capacité à empêcher la croissance de micro-organismes nuisibles fait de l’acide formique un choix courant comme agent conservateur et antibactérien dans l’alimentation animale et l’ensilage.
- Il aide à prévenir la croissance de micro-organismes nuisibles dans les aliments pour animaux et l’ensilage, ce qui en fait un additif utile.
- L’industrie textile utilise l’acide formique comme agent de teinture et de finition des tissus afin d’améliorer la solidité des couleurs et d’augmenter l’affinité des colorants avec les fibres.
- L’acide formique sert de solvant et d’intermédiaire dans la production de divers produits chimiques comme l’acide acétique, le formamide et le méthanol.
- L’acide formique est un agent de bronzage utilisé dans l’industrie du cuir qui contribue à améliorer la texture et la durabilité des produits en cuir.
- Dans la production du caoutchouc, l’acide formique facilite le processus de vulcanisation en servant de coagulant.
- L’industrie pharmaceutique utilise l’acide formique comme conservateur pour les vaccins et comme désinfectant pour le matériel médical.
- De plus, l’acide formique trouve des applications dans la production de divers médicaments, notamment des diurétiques et des antihistaminiques.
- L’acide formique est un agent réducteur dans les réactions de synthèse organique et un catalyseur dans les réactions de polymérisation.
- L’acide formique contribue à rehausser l’arôme de divers produits, ce qui le rend utile dans la production d’arômes et de parfums.
Dans l’ensemble, la diversité des applications de l’acide formique dans diverses industries est due à ses propriétés uniques et à sa nature polyvalente.
Des questions:
Q. L’acide formique est-il un acide fort ?
A. L’acide formique est un acide faible, avec une valeur pKa d’environ 3,75. Cela signifie qu’il ne se dissocie pas complètement dans l’eau et qu’il s’agit d’un acide plus faible que les acides forts tels que l’acide chlorhydrique ou l’acide sulfurique.
Q. Quel est l’acide formique ou acétique le plus acide ?
A. L’acide formique est plus acide que l’acide acétique. Cela est dû à la présence d’un groupe méthyle dans l’acide acétique qui stabilise la charge négative sur la base conjuguée, la rendant moins susceptible de se dissocier. D’autre part, l’acide formique a une taille moléculaire plus petite et un atome électronégatif (oxygène) plus fort, ce qui facilite sa dissociation et le rend plus acide.
Q. L’acide formique est produit par quelle fourmi ?
R. L’acide formique est produit par plusieurs espèces de fourmis, notamment les fourmis des bois, les fourmis de feu et certaines espèces d’abeilles sans dard. L’acide est stocké dans le corps de la fourmi et est utilisé comme mécanisme de défense contre les prédateurs. Lorsqu’elle est menacée, la fourmi peut projeter de l’acide formique à partir de son dard ou le libérer à partir de glandes spécialisées de son corps.
