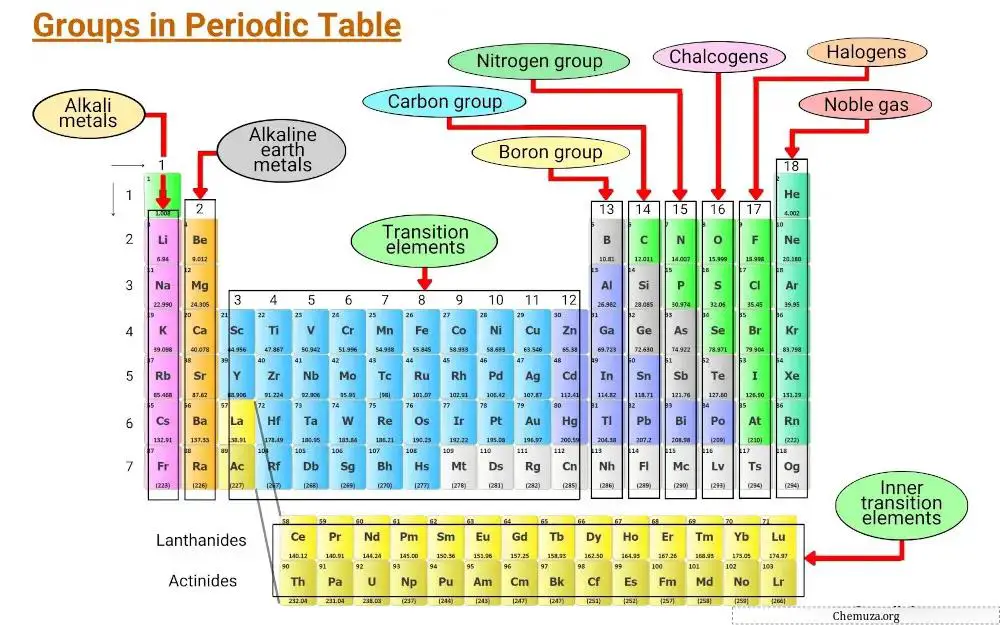
Les éléments sont regroupés en fonction de caractéristiques communes, notamment les configurations électroniques et le comportement des électrons de valence.
Les colonnes verticales du tableau périodique sont appelées groupes et il existe 18 groupes dans le tableau périodique, chacun avec son propre ensemble de propriétés qui déterminent la manière dont un élément interagira avec d’autres éléments et formera des composés.
Dans cet article, nous explorerons les différents groupes du tableau périodique.
Allons-y directement !.
Groupe 1 : Métaux alcalins
Le groupe 1 du tableau périodique est connu sous le nom de métaux alcalins .
Ce groupe comprend le lithium, le sodium, le potassium, le rubidium, le césium et le francium.
Les métaux alcalins sont connus pour leur douceur, leur faible point de fusion et leur grande réactivité avec l’eau et l’air.
Les métaux alcalins sont très réactifs car ils n’ont qu’un seul électron dans leur couche la plus externe, qu’ils abandonnent facilement pour former des ions positifs. [1]
Cela en fait d’excellents conducteurs d’électricité et utiles dans de nombreuses applications, notamment les batteries et les processus industriels.
Cependant, en raison de leur grande réactivité, les métaux alcalins doivent être manipulés avec précaution. Ils peuvent s’enflammer spontanément dans l’air et réagir de manière explosive avec l’eau, libérant de l’hydrogène gazeux. [2]
Groupe 2 : Métaux alcalino-terreux
Le groupe 2 du tableau périodique est connu sous le nom de « métaux alcalino-terreux ». Ce groupe comprend six éléments : le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium.
Ces métaux sont appelés « alcalins » car ils réagissent avec l’eau pour former des solutions alcalines (basiques) .
Les métaux alcalino-terreux ont des propriétés similaires, notamment des points de fusion et d’ébullition élevés, de faibles densités et la capacité de former facilement des ions avec une charge +2.
Ils sont également très réactifs, notamment avec l’eau et l’oxygène. Cependant, contrairement aux métaux alcalins du groupe 1, ils sont moins réactifs et ont un point de fusion plus élevé.
Ces éléments se trouvent dans de nombreux objets du quotidien, notamment les os (calcium), les feux d’artifice (strontium) et les pièces d’avion (magnésium).
Les métaux alcalino-terreux sont également utilisés dans des processus industriels, tels que la production d’aluminium et d’acier.
Groupe 3 – 11 : Métaux de transition
Le groupe 3 à 11 du tableau périodique est connu sous le nom de groupe des métaux de transition . Ces métaux ont des caractéristiques uniques qui les distinguent des autres éléments présents sur la table.
L’une des caractéristiques déterminantes des métaux de transition est leur capacité à former des composés colorés.
Cela est dû à leurs configurations électroniques uniques, qui leur permettent d’absorber et de réfléchir certaines longueurs d’onde de la lumière. [3]
Les métaux de transition sont également connus pour leurs points de fusion et d’ébullition élevés, ainsi que pour leur résistance et leur durabilité.
Ils sont souvent utilisés dans les matériaux de construction, le câblage électrique et même les bijoux.
Groupe 13 : groupe du bore
Le groupe 13 du tableau périodique est connu sous le nom de groupe du bore et comprend les éléments bore (B), aluminium (Al), gallium (Ga), indium (In), thallium (Tl) et nihonium (Nh).
Ces éléments partagent certaines caractéristiques qui les rendent chimiquement similaires.
Le bore est le seul métalloïde de ce groupe, ce qui signifie qu’il possède à la fois les propriétés des métaux et des non-métaux .
Groupe 14 : Groupe carbone
Le groupe 14 du tableau périodique est connu sous le nom de groupe Carbone et comprend le carbone (C), le silicium (Si), le germanium (Ge), l’étain (Sn), le plomb (Pb) et le Flerovium (Fl).
Ces éléments ont des propriétés similaires car ils possèdent tous quatre électrons de valence.
Le carbone est un élément très important car il constitue la base de toutes les molécules organiques, y compris les éléments constitutifs de la vie tels que les protéines et l’ADN. [4]
Groupe 15 : Pnictogènes
Le groupe 15 du tableau périodique est également connu sous le nom de groupe de l’azote (ou pnictogènes).
Ce groupe contient 6 éléments : l’azote (N), le phosphore (P), l’arsenic (As), l’antimoine (Sb), le bismuth (Bi) et le moscovium (Mc).
Les éléments du groupe 15 ont cinq électrons de valence dans leur couche électronique la plus externe, ce qui signifie qu’ils ont tendance à former trois liaisons covalentes pour compléter leur octet.
Ils ont également tendance à gagner trois électrons pour former des anions . Les éléments deviennent moins non métalliques et plus métalliques dans le groupe.
Groupe 16 : Chalcogènes
Le groupe 16 du tableau périodique est connu sous le nom de groupe oxygène. Il comprend les éléments oxygène (O), soufre (S), sélénium (Se), tellure (Te), polonium (Po) et hépatique (Lv).
Ces éléments partagent certaines caractéristiques, notamment le fait d’avoir six électrons de valence dans leur niveau d’énergie le plus externe.
L’oxygène est l’élément le plus abondant de ce groupe et est essentiel à la vie, car il est un composant clé de l’eau et de nombreuses molécules organiques.
Les éléments du groupe oxygène peuvent former des composés avec de nombreux autres éléments, notamment des métaux et des non-métaux .
Groupe 17 : Halogènes
Le groupe 17 du tableau périodique est également connu sous le nom de groupe halogène . Il est composé de six éléments : le fluor, le chlore, le brome, l’iode, l’astatine et la tennessine.
Tous les halogènes ont sept électrons dans leur couche la plus externe, également connue sous le nom de couche de valence. Cela les rend très réactifs, car ils n’ont besoin que d’un électron supplémentaire pour compléter leur enveloppe externe et devenir stables.
Une autre caractéristique importante des halogènes est qu’ils sont tous des non-métaux, ce qui signifie qu’ils ne conduisent pas l’électricité et ne sont pas malléables ou ductiles comme les métaux.
Ils existent également dans les trois états de la matière à température ambiante, le fluor et le chlore étant des gaz, le brome un liquide et l’iode et l’astate des solides.
Groupe 18 : Gaz rares
Le groupe 18 du tableau périodique est également connu sous le nom de gaz rares .
Les gaz rares comprennent l’hélium (He), le néon (Ne), l’argon (Ar), le krypton (Kr), le xénon (Xe) et le radon (Rn).
Ces gaz sont dits nobles car ils sont très stables et ne réagissent pas facilement avec d’autres éléments.
Les gaz rares sont situés dans la colonne la plus à droite du tableau périodique et ils ont tous une couche externe complète d’électrons, ce qui les rend très peu réactifs.
Ils sont également inodores, incolores et ont de faibles points d’ébullition et de fusion.
