Le gluconate de zinc, formule C12H22O14Zn, soutient la fonction immunitaire et la cicatrisation des plaies. Il aide à maintenir la santé de la peau et joue un rôle dans les réactions enzymatiques au sein du corps.
| Nom UICPA | D-gluconate de zinc |
| Formule moléculaire | C12H22O14Zn |
| Numero CAS | 4468-02-4 |
| Synonymes | Gluconate de zinc (II), sel de zinc de l’acide gluconique, gluconate de zinc |
| InChI | InChI=1S/2C6H12O7.Zn/c2 7-1-2(8)3(9)4(10)5(11)6(12)13;/h2 2-5,7-11H,1H2,(H, 12,13);/q;;+2/p-2/t2*3-,4+,5-;/m11./s1 |
Propriétés du gluconate de zinc
Formule de gluconate de zinc
La formule du sel de zinc de l’acide gluconique est C12H22O14Zn. Il représente la disposition des atomes dans une molécule. Cette formule met en évidence la présence d’atomes de carbone, d’hydrogène, d’oxygène et de zinc au sein du composé.
Gluconate De Zinc Masse molaire
Le sel de zinc de l’acide gluconique a une masse molaire d’environ 455,68 g/mol. La masse molaire signifie la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de ses éléments constitutifs.
Point d’ébullition du gluconate de zinc
Le sel de zinc de l’acide gluconique n’a pas de point d’ébullition spécifique, car il se décompose avant d’atteindre le point d’ébullition en raison de sa structure moléculaire et de ses propriétés.
Gluconate de Zinc Point de fusion
Le point de fusion du sel de zinc de l’acide gluconique se situe généralement entre 120°C et 130°C. C’est la température à laquelle le composé solide passe à l’état liquide.
Densité du gluconate de zinc g/mL
La densité du sel de zinc de l’acide gluconique varie, mais elle se situe généralement autour de 1,86 g/mL. La densité mesure la masse d’une substance par unité de volume et donne un aperçu de sa compacité.
Gluconate De Zinc Poids moléculaire
Avec un poids moléculaire d’environ 455,68 g/mol, le poids moléculaire du sel de zinc de l’acide gluconique est la somme des poids atomiques de tous les atomes présents dans une seule molécule du composé.
Structure du gluconate de zinc
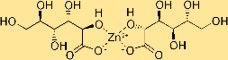
Le sel de zinc de l’acide gluconique présente une structure dans laquelle un ion zinc est coordonné avec des ligands gluconates. Ces ligands sont dérivés de l’acide gluconique, les atomes de carbone, d’hydrogène et d’oxygène formant un arrangement spécifique autour de l’atome central de zinc.
Solubilité du gluconate de zinc
Le sel de zinc de l’acide gluconique est modérément soluble dans l’eau. Cette solubilité résulte de l’interaction entre les molécules d’eau polaires et les régions ioniques ou polaires du composé, lui permettant de se dissoudre et de former une solution. La solubilité du sel de zinc de l’acide gluconique le rend adapté à diverses applications, notamment les compléments alimentaires.
| Apparence | Poudre blanche ou blanc cassé |
| Gravité spécifique | ~1,86 g/cm³ |
| Couleur | Incolore à jaune pâle |
| Odeur | Inodore |
| Masse molaire | ~455,68 g/mole |
| Densité | ~1,86 g/mL |
| Point de fusion | 120°C – 130°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Modérément soluble dans l’eau |
| Solubilité | Soluble dans les solutions aqueuses |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | ~12,4 (pour l’acide gluconique) |
| pH | Légèrement acide à neutre |
Sécurité et dangers du gluconate de zinc
Le sel de zinc de l’acide gluconique est généralement considéré comme sûr lorsqu’il est utilisé dans les compléments alimentaires et les médicaments aux doses recommandées. Cependant, une consommation excessive peut entraîner des maux d’estomac et des nausées. Évitez d’inhaler sa poudre et assurez-vous de la manipuler correctement pour éviter les irritations. Bien que faiblement toxique, l’ingestion de grandes quantités peut entraîner des effets indésirables. Comme pour toute manipulation de substance, il est sage de respecter les consignes de sécurité, de la stocker correctement et de consulter des professionnels de la santé avant utilisation, surtout si vous êtes enceinte, si vous allaitez ou si vous avez des problèmes de santé sous-jacents.
| Symboles de danger | Aucun symbole de danger |
| Description de la sécurité | Généralement considéré comme sûr dans des utilisations spécifiées, mais une consommation excessive peut entraîner un inconfort |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2918.15.0000 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité avec une consommation excessive entraînant un inconfort |
Méthodes de synthèse du gluconate de zinc
Le sel de zinc de l’acide gluconique peut être synthétisé par différentes méthodes. Une approche courante consiste à faire réagir l’oxyde de zinc ou le carbonate de zinc avec de l’acide gluconique. Dans cette méthode, l’ oxyde de zinc ou le carbonate de zinc est dissous dans l’eau pour former une solution d’hydroxyde de zinc. L’acide gluconique est ensuite ajouté à la solution, conduisant à une réaction qui produit du sel de zinc d’acide gluconique et d’eau. Le mélange est généralement chauffé et agité pour faciliter la réaction et assurer une conversion complète.
Une autre méthode implique la réaction entre l’oxyde de zinc et la gluconolactone. La gluconolactone est hydrolysée en présence d’eau pour produire de l’acide gluconique, qui réagit ensuite avec l’oxyde de zinc pour donner le sel de zinc de l’acide gluconique.
Ces méthodes nécessitent généralement des conditions contrôlées, telles que des températures et des niveaux de pH spécifiques, pour optimiser la réaction. Des étapes de purification peuvent être utilisées pour obtenir un produit plus raffiné. La synthèse du sel de zinc de l’acide gluconique est cruciale pour ses diverses applications, notamment les compléments alimentaires et les produits pharmaceutiques. Il est important de noter que même si ces méthodes produisent du sel de zinc d’acide gluconique, les procédures et conditions spécifiques peuvent varier en fonction de la qualité du produit souhaitée et de l’échelle de production.
Utilisations du gluconate de zinc
Le sel de zinc de l’acide gluconique trouve une gamme d’applications en raison de ses propriétés bénéfiques et de sa polyvalence. Ses utilisations couvrent diverses industries et domaines, ce qui en fait un composé important à des fins multiples.
- Compléments alimentaires : Les compléments alimentaires utilisent couramment le sel de zinc de l’acide gluconique comme minéral essentiel soutenant la fonction immunitaire, la cicatrisation des plaies et la santé globale.
- Produits pharmaceutiques : divers médicaments en vente libre et sur ordonnance contiennent du sel de zinc de l’acide gluconique comme ingrédient actif, notamment des remèdes contre le rhume, des pastilles orales et des crèmes pour la peau, en raison de ses propriétés antivirales et cicatrisantes potentielles.
- Produits de soins de la peau : Le sel de zinc de l’acide gluconique joue un rôle crucial dans les produits de soins de la peau en favorisant la cicatrisation des plaies, en aidant à la réparation et au rajeunissement de la peau.
- Santé bucco-dentaire : Les produits d’hygiène bucco-dentaire comme le dentifrice et les bains de bouche contiennent du sel de zinc d’acide gluconique, contribuant à la santé bucco-dentaire et à la prévention des problèmes dentaires.
- Applications industrielles : Les industries utilisent le sel de zinc de l’acide gluconique comme additif nutritif dans les aliments et les boissons pour les enrichir de zinc, un micronutriment vital.
- Additif nutritionnel : Le sel de zinc de l’acide gluconique agit comme un additif nutritionnel dans l’alimentation animale, garantissant un apport adéquat en zinc au bétail, favorisant ainsi sa santé et sa croissance.
- Galvanisation : Dans certains cas, le sel de zinc de l’acide gluconique participe aux processus de galvanisation pour recouvrir les métaux d’une couche de zinc pour la résistance à la corrosion.
- Amélioration de la saveur : L’industrie alimentaire exploite le sel de zinc de l’acide gluconique pour rehausser les saveurs et améliorer la texture de produits spécifiques.
- Poudres médicamenteuses : Le sel de zinc de l’acide gluconique, connu pour ses propriétés apaisantes, devient un composant des poudres médicamenteuses, aidant à soulager les irritations cutanées.
- Produits nutraceutiques : le sel de zinc de l’acide gluconique trouve une application dans les formulations nutraceutiques, mélangeant les aspects nutritionnels et pharmaceutiques pour offrir des bienfaits pour la santé.
Des questions:
Q : Le gluconate de zinc est-il sans danger dans les déodorants ?
R : Oui, le sel de zinc de l’acide gluconique est utilisé dans les déodorants pour ses propriétés antibactériennes, aidant à contrôler les bactéries responsables des odeurs.
Q : Le gluconate de zinc 50 mg est-il bon contre le rhume ?
R : Le sel de zinc de l’acide gluconique à 50 mg peut aider à soutenir la fonction immunitaire en cas de rhume, mais consultez un professionnel de la santé pour obtenir des conseils personnalisés.
Q : Le gluconate de zinc est-il chélaté ?
R : Le sel de zinc de l’acide gluconique n’est généralement pas considéré comme une forme chélatée du zinc ; c’est un sel formé de zinc et d’acide gluconique.
Q : Le gluconate de zinc est-il résorbable ?
R : Le sel de zinc de l’acide gluconique est absorbable, mais l’absorption peut varier en fonction de facteurs tels que la posologie, les facteurs alimentaires et les différences individuelles.
Q : Quelle est la différence entre le gluconate de zinc et le picolinate de zinc ?
R : Le sel de zinc de l’acide gluconique et le picolinate de zinc sont différentes formes de zinc, affectant potentiellement les taux d’absorption et la compatibilité avec les individus.
Q : Quel type de réaction est Zn + S = ZnS ?
R : La réaction Zn + S = ZnS est une réaction de synthèse ou de combinaison, formant du sulfure de zinc (ZnS) à partir de ses éléments.
Q : Pouvez-vous prendre trop de gluconate de zinc ?
R : Oui, une consommation excessive de gluconate de zinc peut entraîner des effets indésirables, notamment un inconfort gastro-intestinal ; respecter les doses recommandées.
Q : Le gluconate de zinc est-il comparable au gluconate de chlorhexidine ?
R : Le sel de zinc de l’acide gluconique et le gluconate de chlorhexidine servent à des fins différentes ; le zinc est utilisé dans les suppléments, tandis que la chlorhexidine est un antiseptique.
Q : Dans quelle mesure le gluconate de zinc est-il absorbable ?
R : L’absorption du sel de zinc de l’acide gluconique dépend de facteurs tels que la formulation et de facteurs individuels ; il est généralement considéré comme raisonnablement résorbable.
Q : Le sulfate de zinc est-il identique au gluconate de zinc ?
R : Non, le sulfate de zinc et le gluconate de zinc sont des composés différents, avec des propriétés, des utilisations et des effets potentiels variables.
Q : Quels éléments contiennent le gluconate de zinc ?
R : Le sel de zinc de l’acide gluconique est constitué d’éléments zinc, carbone, hydrogène et oxygène, formant le composé C12H22O14Zn.
