Le fluorure de zinc (ZnF2) est un composé chimique. Il est formé de zinc et de fluor. Il est utilisé dans diverses industries comme les soins dentaires et l’électronique en raison de ses propriétés uniques.
| Nom UICPA | Fluorure de zinc |
| Formule moléculaire | ZnF2 |
| Numero CAS | 7783-49-5 |
| Synonymes | Difluorure de zinc, fluorure de zinc (II) |
| InChI | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Propriétés du fluorure de zinc
Formule de fluorure de zinc
La formule chimique du difluorure de zinc est ZnF2. Cette formule signifie que chaque molécule de difluorure de zinc est constituée d’un atome de zinc (Zn) et de deux atomes de fluor (F).
Fluorure De Zinc Masse molaire
La masse molaire du difluorure de zinc (ZnF2) est d’environ 103,38 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de zinc et de deux atomes de fluor.
Point d’ébullition du fluorure de zinc
Le difluorure de zinc a un point d’ébullition d’environ 872°C (1602°F). Il s’agit de la température à laquelle le composé passe de l’état liquide à l’état gazeux sous pression atmosphérique standard.
Fluorure de zinc Point de fusion
Le point de fusion du difluorure de zinc est d’environ 872°C (1602°F). À cette température, la forme solide du difluorure de zinc se transforme en liquide.
Densité du fluorure de zinc g/mL
La densité du difluorure de zinc est d’environ 4,95 g/mL. Cette valeur représente la masse du composé par unité de volume et indique sa lourdeur.
Fluorure De Zinc Poids moléculaire
Le poids moléculaire du difluorure de zinc (ZnF2) est d’environ 103,38 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes d’une molécule du composé.
Structure du fluorure de zinc
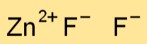
Le difluorure de zinc (ZnF2) a une structure cristalline dans laquelle chaque atome de zinc est entouré de quatre ions fluorure disposés dans un arrangement tétraédrique. Cette disposition contribue à la stabilité du composé.
Solubilité du fluorure de zinc
Le difluorure de zinc démontre une solubilité limitée dans l’eau. Il est peu soluble, ce qui signifie que seule une petite quantité du composé peut se dissoudre dans l’eau pour former une solution. Cette caractéristique est importante pour diverses applications industrielles et procédés chimiques.
| Apparence | Solide blanc |
| Gravité spécifique | 4,95 g/cm³ |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 103,38 g/mole |
| Densité | 4,95 g/ml |
| Point de fusion | 872°C (1602°F) |
| Point d’ébullition | 872°C (1602°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité limitée |
| Solubilité | Peu soluble, seule une petite quantité peut se dissoudre dans l’eau |
| La pression de vapeur | Pas bien défini |
| Densité de vapeur | Pas bien défini |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du fluorure de zinc
Le difluorure de zinc (ZnF2) pose certaines considérations de sécurité. Il est important de manipuler ce composé avec précaution. Évitez l’inhalation ou l’ingestion, car cela peut entraîner une irritation respiratoire et gastro-intestinale. Lorsque vous travaillez avec du ZnF2, portez un équipement de protection individuelle approprié comme des gants et des lunettes de sécurité pour éviter tout contact avec la peau et les yeux. En cas de contact accidentel, rincer abondamment à l’eau les zones concernées. Conserver le difluorure de zinc à l’écart des matériaux incompatibles et des sources de chaleur. Bien qu’il ne soit pas très toxique, il est sage de suivre les procédures de manipulation appropriées et d’assurer une bonne ventilation afin de minimiser les risques potentiels associés à son utilisation.
| Symboles de danger | Corrosif, Irritant, Toxique Aigu |
| Description de la sécurité | Manipuler avec soin. Évitez l’inhalation et l’ingestion. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 28261900 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse du fluorure de zinc
Le difluorure de zinc peut être synthétisé par diverses méthodes. Une approche courante implique la réaction entre l’oxyde de zinc (ZnO) et l’acide fluorhydrique (HF) . Dans cette méthode, ZnO est mélangé avec HF, entraînant la formation de difluorure de zinc et d’eau. Une autre méthode implique la réaction entre le carbonate de zinc (ZnCO3) et l’acide fluorhydrique. Le carbonate de zinc réagit avec le HF pour produire du difluorure de zinc, du dioxyde de carbone et de l’eau.
De plus, le difluorure de zinc peut également être préparé en faisant réagir du zinc métallique avec du fluor gazeux (F2) à des températures élevées. Cette réaction produit directement du difluorure de zinc avec dégagement de chaleur.
En outre, des méthodes de précipitation peuvent être utilisées, dans lesquelles des sels de zinc solubles réagissent avec des sels de fluorure solubles pour former du difluorure de zinc insoluble, qui peut ensuite être séparé et collecté.
Il est important de faire preuve de prudence lors de ces processus de synthèse en raison de la réactivité des produits chimiques impliqués. Des mesures de sécurité et des équipements appropriés doivent être utilisés pour garantir la synthèse réussie et sûre du difluorure de zinc.
Utilisations du fluorure de zinc
Le difluorure de zinc (ZnF2) trouve des applications polyvalentes dans diverses industries en raison de ses propriétés uniques. Voici ses principales utilisations :
- Soins dentaires : Renforcez l’émail des dents et améliorez l’hygiène bucco-dentaire en incorporant du ZnF2 dans les formulations de dentifrice.
- Optiques et revêtements : améliorent les propriétés antireflet des lentilles et améliorent la transmission de la lumière en utilisant du ZnF2 dans les revêtements optiques.
- Électronique : intégrez le ZnF2 dans les écrans à transistors à couches minces (TFT) pour créer des films conducteurs transparents.
- Source d’ions fluorure : utilisez le ZnF2 comme source d’ions fluorure dans les cellules électrolytiques pour aider à produire des métaux réactifs comme l’aluminium.
- Synthèse chimique : utiliser le ZnF2 comme catalyseur et agent fluorant dans diverses réactions chimiques pour faciliter la synthèse de produits pharmaceutiques et agrochimiques.
- Galvanisation : appliquez du ZnF2 dans les processus de finition des métaux sur les surfaces métalliques prêtes à être galvanisées, améliorant ainsi l’adhérence et la durabilité.
- Fenêtres infrarouges : Fabriquez des fenêtres de capteurs infrarouges et des systèmes d’imagerie thermique utilisant du ZnF2 en raison de sa transparence dans la région infrarouge.
- Applications laser : utilisez le ZnF2 comme milieu de gain laser pour contribuer au développement de lasers accordables à des fins scientifiques et industrielles.
- Croissance cristalline : incorporez du ZnF2 dans les processus de croissance cristalline pour les semi-conducteurs et autres composants électroniques.
- Recherche chimique : utilisez le ZnF2 comme réactif et réactif dans diverses réactions chimiques à l’échelle du laboratoire, facilitant ainsi l’exploration de nouveaux composés.
Ces diverses applications mettent en évidence l’importance du difluorure de zinc dans les technologies modernes, la fabrication et la recherche scientifique dans de multiples domaines.
Des questions:
Q : Quelle est la formule chimique du fluorure de zinc ?
R : La formule chimique du difluorure de zinc est ZnF2.
Q : Quelle est la formule du fluorure de zinc(II) ?
R : La formule du difluorure de zinc(II) est ZnF2.
Q : Quelle est la formule du composé ionique formé à partir d’ions zinc et fluorure ?
R : La formule du composé ionique formé à partir d’ions Zn+2 et fluorure est ZnF2.
Q : Que peut-il arriver en raison de carences en zinc, en iode ou en fluorure ?
R : Les carences en Zn, en iode ou en fluorure peuvent entraîner divers problèmes de santé, affectant le métabolisme, la fonction thyroïdienne et la santé dentaire.
Q : Lequel des éléments suivants n’a pas de RDA ? un. le fer B. le zinc c. l’iode d. fluorure
R : Le fluorure n’a pas d’apport nutritionnel recommandé (AJR).
Q : Comment le fluorure de zinc peut-il affecter un humain ?
R : Le difluorure de zinc peut affecter les humains par ingestion, inhalation ou contact cutané potentiel, provoquant éventuellement une irritation ou une toxicité.
Q : Le ZnF2 est-il ionique ou moléculaire ?
R : ZnF2 est un composé ionique.
Q : Pourquoi s’agit-il de ZnF2 et non de ZnF ?
R : ZnF2 indique que chaque atome de Zn est lié à deux ions F, formant la stœchiométrie correcte.
Q : Le ZnF2 et le NaOH formeront-ils un précipité ?
R : Oui, ZnF2 et NaOH peuvent former un précipité blanc d’hydroxyde de zinc (Zn(OH)2).
Q : Le ZnF2 est-il soluble ?
R : Le ZnF2 est peu soluble dans l’eau.
Q : Quel est le nom du composé de formule ZnF2 ?
R : Le composé de formule ZnF2 est appelé difluorure de zinc.
Q : Le Ksp du ZnF2 est de 3,0 × 10⁻² à 25°C. Qu’est-ce que ΔG° ?
R : La valeur de ΔG° peut être calculée sur la base de la valeur Ksp et de la température données en utilisant l’équation thermodynamique appropriée.
Q : Qu’est-ce que le ZnF2 ?
R : ZnF2 est la formule chimique du difluorure de zinc, un composé de zinc et de fluor.
Q : Combien de moles dans ZnF2 ?
R : Le nombre de moles dans ZnF2 dépend de la masse donnée et de la masse molaire du composé.
