Le fluorure de sodium (NaF) est un composé chimique utilisé pour prévenir la carie dentaire. Il renforce l’émail des dents en le reminéralisant et inhibe la croissance des bactéries buccales nocives.
| Nom de l’UICPA | Le fluorure de sodium |
| Formule moléculaire | NaF |
| Numero CAS | 7681-49-4 |
| Synonymes | Monofluorure de sodium, Fluorure de sodium anhydre, Fluorure monosodique, Fluorure de sodium, |
| Solutia SFL, Fluka 01178, 3M ESPE 12104, Fluorure de sodium puriss., Fluorure de sodium extrapur | |
| InChI | InChI=1S/FH.Na/h1H;/q;+1/p-1 |
Propriétés du fluorure de sodium
Formule de fluorure de sodium
La formule chimique du fluorure de sodium est NaF. Cela signifie que chaque molécule de NaF est constituée d’un ion Na+ et d’un ion F-. La formule est importante en chimie car elle fournit des informations sur les types et le nombre d’atomes ou d’ions dans une molécule d’une substance.
Fluorure De Sodium Masse molaire
La masse molaire de NaF est de 41,99 g/mol. C’est la somme des masses atomiques d’un atome de sodium et d’un atome de fluor, qui sont respectivement de 22,99 g/mol et 19,00 g/mol. La masse molaire est une propriété importante en chimie car elle permet de calculer le nombre de moles d’une substance en fonction de sa masse, et vice versa.
Point d’ébullition du fluorure de sodium
Le point d’ébullition du NaF est de 1 705 °C (3 101 °F). Il s’agit de la température à laquelle la forme liquide du NaF passe à sa forme gazeuse. NaF a un point d’ébullition relativement élevé par rapport aux autres composés F en raison de sa forte liaison ionique entre les ions Na+ et les ions F-.
Point de fusion du fluorure de sodium
Le point de fusion du NaF est de 993°C (1 819°F). Il s’agit de la température à laquelle la forme solide du NaF passe à sa forme liquide. NaF a un point de fusion relativement élevé en raison de sa forte liaison ionique entre les ions Na+ et les ions F-.
Densité du fluorure de sodium g/mL
La densité de NaF est de 2,79 g/mL. Cela signifie qu’un millilitre de NaF pèse 2,79 grammes. La densité est une propriété importante d’une substance car elle peut être utilisée pour déterminer la masse d’une substance en fonction de son volume, ou le volume d’une substance en fonction de sa masse.
Fluorure De Sodium Poids moléculaire
Le poids moléculaire de NaF est de 41,99 g/mol. C’est la somme des poids atomiques du sodium et du fluor dans une molécule de NaF. Le poids moléculaire est important en chimie car il permet de calculer diverses propriétés d’une substance, telles que sa densité et sa molarité.
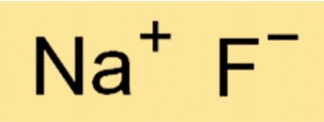
Structure du fluorure de sodium
NaF a une structure cristalline sous sa forme solide. Il se compose d’ions Na+ et d’ions F- disposés dans une structure en réseau cubique. Les ions Na+ occupent les coins du cube, tandis que les ions fluorure occupent les centres des faces du cube. Cet arrangement se traduit par une forte liaison ionique entre les ions Na+ et les ions F-.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,79 g/cm³ |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 41,99 g/mole |
| Densité | 2,79 g/ml |
| Point de fusion | 993°C (1 819°F) |
| Point d’ébullition | 1 705 °C (3 101 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 4,24 g/100 ml (20 °C) |
| Solubilité | Soluble dans l’alcool et l’éther |
| Pression de vapeur | 1 mmHg (713 °C) |
| Densité de vapeur | 2,9 (air = 1) |
| pKa | 7.2 |
| pH | 7,6-8,4 (solution aqueuse 0,1 M) |
Sécurité et dangers du fluorure de sodium
NaF a quelques problèmes de sécurité et de danger. Il est toxique s’il est ingéré en grande quantité et peut provoquer des nausées, des vomissements, de la diarrhée et des douleurs abdominales. L’inhalation de poussière de NaF peut provoquer une irritation respiratoire et des lésions pulmonaires. Il peut également provoquer une irritation des yeux et de la peau au contact. NaF est également corrosif pour certains métaux et peut réagir violemment avec des acides forts. Des procédures appropriées de manipulation, de stockage et d’élimination doivent être suivies lorsque vous travaillez avec NaF pour éviter ces dangers. Il est important de toujours porter un équipement de protection individuelle approprié lors de la manipulation du NaF.
| Symboles de danger | T, N |
| Description de la sécurité | Éviter l’ingestion, l’inhalation, le contact avec la peau et les yeux. Portez un EPI approprié. Suivre les procédures sécuritaires de manipulation, de stockage et d’élimination. |
| Numéros d’identification de l’ONU | UN1690 (pour solide) |
| Code SH | 2826.12.00 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation en grande quantité. Peut provoquer une irritation des voies respiratoires, des yeux et de la peau. Corrosif pour certains métaux. |
Méthodes de synthèse du fluorure de sodium
Les chimistes utilisent plusieurs méthodes pour synthétiser le fluorure de sodium (NaF).
Une méthode courante consiste à faire réagir l’acide fluorhydrique avec de l’hydroxyde de sodium ou du carbonate de sodium . Pour éliminer toute eau ou impureté, quelqu’un sèche et chauffe le produit obtenu.
Une autre méthode implique la réaction du NaCl avec le HF , qui produit du NaF et du chlorure d’hydrogène comme sous-produits. Cette méthode est moins courante en raison de problèmes de sécurité associés à la manipulation du fluorure d’hydrogène.
Une autre façon de synthétiser NaF consiste à faire réagir du carbonate de sodium avec du gaz HF . La réaction produit du NaF, du dioxyde de carbone et de la vapeur d’eau. Les applications industrielles utilisent couramment cette méthode pour produire du NaF.
De plus, on peut synthétiser NaF en chauffant du fluor gazeux avec du sodium métallique. Cependant, cette méthode est rare en raison de la forte réactivité du sodium et du fluor. De plus, cette méthode nécessite un équipement spécialisé et une manipulation soigneuse en raison du risque d’explosion.
Utilisations du fluorure de sodium
NaF a plusieurs utilisations dans différents secteurs. Voici quelques utilisations courantes de NaF :
- Hygiène dentaire : le dentifrice, les bains de bouche et les traitements dentaires ajoutent du NaF pour prévenir les caries dentaires et améliorer la santé bucco-dentaire.
- Traitement de l’eau : ajouté à l’eau potable dans certaines régions pour prévenir la carie dentaire.
- Applications industrielles : Utilisé comme flux dans la production d’aluminium et dans la production de verre et de céramique pour abaisser le point de fusion et améliorer la transparence.
- Métallurgie : Utilisé dans le raffinage et le traitement des métaux, par exemple pour l’élimination des impuretés dans la production d’acier et d’aluminium.
- Pesticide : Utilisé comme pesticide dans la lutte contre les rongeurs et les insectes.
- Chimie : Utilisé comme source d’ions fluorure dans diverses réactions chimiques.
- Industrie nucléaire : Utilisé comme caloporteur et agent de transfert de chaleur dans certains réacteurs nucléaires.
- Produits pharmaceutiques : utilisés dans la fabrication de certains médicaments, tels que les antidépresseurs et les anti-inflammatoires.
Des questions:
Q : Le fluorure de sodium présent dans le dentifrice est-il mauvais pour la santé ?
R : Le NaF présent dans le dentifrice est généralement considéré comme sûr lorsqu’il est utilisé selon les instructions. Il aide à prévenir la carie dentaire et est approuvé par les associations dentaires du monde entier. Cependant, une ingestion excessive de dentifrice peut entraîner des maux d’estomac et d’autres problèmes de santé.
Q : Une solution diluée ou concentrée de fluorure de sodium aurait-elle un point d’ébullition plus élevé ?
R : Une solution concentrée de NaF aurait un point d’ébullition plus élevé qu’une solution diluée en raison du nombre accru de particules de soluté dans la solution, ce qui augmente le point d’ébullition par l’effet d’élévation du point d’ébullition.
Q : Combien de grammes contiennent 4,5 moles de fluorure de sodium ?
R : La masse molaire de NaF est de 41,99 g/mol, donc 4,5 moles de NaF équivaudraient à 188,96 grammes.
Q : Le fluorure de sodium est-il ionique ou covalent ?
R : NaF est un composé ionique, formé par l’attraction électrostatique entre l’ion Na+ et l’ion F-.
Q : Quelle est la manière correcte de représenter le composé ionique fluorure de sodium ?
R : La façon correcte de représenter ce composé ionique est NaF, où Na représente le Na+ et F représente le F-.
Q : Quel est le nom du composé de formule NaF ?
R : Le nom du composé de formule NaF est fluorure de sodium.
Q : NaF est-il un acide ou une base ?
R : NaF est un sel formé à partir de la réaction de neutralisation entre une base forte (hydroxyde de sodium) et un acide faible (acide fluorhydrique). Ce n’est ni un acide ni une base, mais il peut subir une hydrolyse pour former une solution basique.
