Le fluorure de nickel (NiF2) est un composé chimique. Il est composé d’atomes de nickel et de fluor. Utilisé dans diverses applications, notamment les batteries et la galvanoplastie, en raison de ses propriétés uniques.
| Nom UICPA | Fluorure de nickel(II) |
| Formule moléculaire | NiF2 |
| Numero CAS | 10028-18-9 |
| Synonymes | Difluorure de nickel, fluorure de nickel, difluoronickel |
| InChI | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
Propriétés du fluorure de nickel
Formule de fluorure de nickel
La formule chimique du difluorure de nickel est NiF2. Cela signifie que chaque molécule de difluorure de nickel est constituée d’un atome de nickel et de deux atomes de fluor liés ensemble.
Fluorure De Nickel Masse molaire
Le difluorure de nickel a une masse molaire d’environ 96,69 grammes par mole. Cette valeur est calculée en additionnant les masses atomiques d’un atome de nickel (58,69 g/mol) et de deux atomes de fluor (18,998 g/mol chacun).
Point d’ébullition du fluorure de nickel
Le point d’ébullition du difluorure de nickel est relativement élevé, autour de 1 568 degrés Celsius (2 854 degrés Fahrenheit). Cette température représente le point auquel le difluorure de nickel passe de sa phase liquide à un état gazeux.
Fluorure de nickel Point de fusion
Le difluorure de nickel a un point de fusion d’environ 1 372 degrés Celsius (2 502 degrés Fahrenheit). C’est la température à laquelle le difluorure de nickel solide se transforme en liquide.
Densité du fluorure de nickel g/mL
La densité du difluorure de nickel est d’environ 4,72 grammes par centimètre cube (g/cm³). Cette valeur de densité donne un aperçu de la densité des particules dans un volume donné de la substance.
Fluorure De Nickel Poids moléculaire
Le poids moléculaire du difluorure de nickel est d’environ 96,69 grammes par mole. Il est déterminé en additionnant les poids atomiques de ses éléments constitutifs dans la formule chimique NiF2.
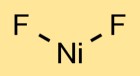
Structure du fluorure de nickel
Le difluorure de nickel a une structure cristalline. L’atome de nickel est au centre, lié à deux atomes de fluor. La disposition des atomes donne lieu à un motif répétitif, formant un réseau cristallin.
Solubilité du fluorure de nickel
Le difluorure de nickel est peu soluble dans l’eau. Sa solubilité est affectée par des facteurs tels que la température et la présence d’autres substances. Lorsqu’il se dissout, il se dissocie en ions Ni+2 et F- dans la solution aqueuse.
| Apparence | Solide cristallin vert |
| Gravité spécifique | 4,72 g/cm³ |
| Couleur | Vert |
| Odeur | Inodore |
| Masse molaire | 96,69 g/mole |
| Densité | 4,72 g/cm³ |
| Point de fusion | 1 372 °C (2 502 °F) |
| Point d’ébullition | 1 568 °C (2 854 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Se dissout dans l’eau, se dissocie en ions nickel et ions fluorure |
| Pression de vapeur | Pas bien défini |
| Densité de vapeur | Pas bien défini |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du fluorure de nickel
Le difluorure de nickel présente des risques potentiels pour la sécurité. Il peut provoquer une irritation de la peau et des yeux au contact. L’inhalation de ses poussières ou de ses fumées peut entraîner une irritation respiratoire. Une exposition prolongée pourrait entraîner des effets plus graves sur la santé. Des mesures de protection appropriées, notamment des gants et des lunettes de sécurité, doivent être utilisées lors de la manipulation du difluorure de nickel. Les espaces de travail doivent être bien ventilés pour minimiser les risques d’inhalation. En cas d’ingestion ou de contact accidentel, des soins médicaux sont nécessaires. L’impact environnemental potentiel du difluorure de nickel doit également être pris en compte, et son élimination doit respecter les réglementations appropriées pour éviter toute contamination.
| Symboles de danger | Danger pour la santé |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Nocif en cas d’inhalation ou d’ingestion. Une exposition prolongée peut entraîner des effets plus graves sur la santé. Manipuler avec un équipement de protection approprié. Évitez l’inhalation et le contact. |
| Numéros d’identification de l’ONU | Non attribué |
| Code SH | 2826.20.1000 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Modérément toxique |
Méthodes de synthèse du fluorure de nickel
Le difluorure de nickel peut être synthétisé par diverses méthodes. Une approche courante implique la réaction entre l’oxyde de nickel (NiO) ou le carbonate de nickel (NiCO3) avec l’acide fluorhydrique (HF) :
- Réaction avec l’acide fluorhydrique :
- Méthode à l’oxyde de nickel (NiO) : NiO + 2 HF → NiF2 + H2O
- Méthode Carbonate de Nickel (NiCO3) : NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
Une autre méthode utilise la réaction entre le chlorure de nickel (NiCl2) et le fluorure d’ammonium (NH4F) :
- Réaction avec le fluorure d’ammonium : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
De plus, le difluorure de nickel peut être obtenu par la réaction de l’oxyde de nickel avec le fluorure d’ammonium :
- Réaction avec le fluorure d’ammonium (méthode à l’oxyde de nickel) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
Ces méthodes se déroulent généralement à des températures et des conditions contrôlées pour garantir une synthèse appropriée et la pureté du produit. Il est essentiel de manipuler l’acide fluorhydrique et les autres réactifs avec prudence en raison de leurs dangers potentiels. Le difluorure de nickel résultant peut être purifié et traité pour diverses applications, telles que les matériaux de batterie et la galvanoplastie.
Utilisations du fluorure de nickel
Le difluorure de nickel (NiF2) trouve diverses applications en raison de ses propriétés uniques. Il sert dans diverses industries à des fins distinctes :
- Technologie de batterie : utilisée comme composant dans les batteries lithium-ion, améliorant leurs performances et leur stabilité.
- Galvanoplastie : utilisée dans les processus de galvanoplastie pour créer des revêtements de nickel durables et résistants à la corrosion sur divers matériaux.
- Catalyse : Agit comme un catalyseur dans certaines réactions chimiques, aidant à la synthèse de produits précieux.
- Verre et céramique : Incorporée dans la production de verre et de céramique spéciaux, améliorant leurs propriétés et caractéristiques.
- Fluoration : utilisée pour la fluoration de l’eau afin d’améliorer la santé dentaire en prévenant la carie dentaire.
- Fabrication de produits chimiques : sert de précurseur dans la synthèse d’autres composés de nickel et substances chimiques.
- Condensateurs céramiques : présents dans la fabrication de condensateurs céramiques utilisés dans l’électronique et les télécommunications.
- Produits pharmaceutiques : utilisés comme réactifs dans certains processus et recherches pharmaceutiques.
- Photographie : historiquement utilisée dans l’industrie photographique comme composant de certains révélateurs photographiques.
- Additif pour alliages métalliques : ajouté à certains alliages métalliques pour améliorer leurs propriétés telles que la résistance et la résistance.
Les caractéristiques adaptables du difluorure de nickel en font une ressource précieuse dans un large éventail d’industries, contribuant aux progrès de la technologie, des soins de santé et de la fabrication.
Des questions:
Q : Quels sont les produits aux deux électrodes lors de l’électrolyse d’une solution de NiF2(aq) ?
R : À la cathode, du nickel métallique (Ni) se forme, tandis qu’à l’anode, du fluor gazeux (F2) se dégage.
Q : Que produit l’électrolyse du NiF2 ?
R : Le nickel métallique est produit à la cathode et du fluor gazeux se dégage à l’anode pendant l’électrolyse du NiF2.
Q : Le composé NiF2 est un composé ionique. Quels sont les ions qui le composent ?
R : NiF2 est composé d’ions nickel (Ni²⁺) et d’ions F-.
Q : Quel type de réaction est Ni(s) + F2 —> NiF2(s) ?
R : La réaction Ni(s) + F2 → NiF2(s) est une réaction de combinaison (synthèse).
Q : Quel est le nom du composé de formule NiF2 ?
R : Le composé de formule NiF2 est appelé difluorure de nickel (II).
Q : Où le fluorure de nickel(II) est-il utilisé ?
R : Le difluorure de nickel (II) est utilisé dans la technologie des batteries, la galvanoplastie, les catalyseurs et la fabrication de céramiques.
Q : Quelle est la formule du fluorure de nickel(II) ?
R : La formule du difluorure de nickel(II) est NiF2.
Q : Le fluorure de nickel(II) et l’hydroxyde de sodium précipitent-ils ?
R : Oui, ils précipitent sous forme d’un solide vert, l’hydroxyde de nickel(II).
Q : Le fluorure de nickel conduit-il l’électricité ?
R : Oui, le difluorure de nickel peut conduire l’électricité à l’état fondu ou lorsqu’il est dissous dans l’eau.
Q : Le fluorure de nickel fondu ou le graphite sont-ils plus conducteurs ?
R : Le difluorure de nickel fondu est plus conducteur que le graphite en raison de sa nature ionique et de ses ions mobiles.
