L’éthylène glycol (C2H6O2) est un liquide clair, inodore et au goût sucré couramment utilisé dans les antigels et d’autres applications industrielles. Il est toxique une fois ingéré et peut entraîner de graves problèmes de santé.
| Nom UICPA | Éthane-1,2-diol |
| Formule moléculaire | C2H6O2 |
| Numero CAS | 107-21-1 |
| Synonymes | 1,2-Éthanediol, Glycol, Monoéthylène glycol, MEG, Alcool éthylène, Acide hypodicarboneux, Éthylène dihydraté |
| InChI | InChI=1S/C2H6O2/c3-1-2-4/h3-4H,1-2H2 |
Propriétés de l’éthylène glycol
Éthylène Glycol Masse molaire
Le monoéthylène glycol (MEG) a une masse molaire de 62,07 g/mol. La masse molaire est la masse d’une mole d’une substance, exprimée en grammes. La masse molaire du monoéthylène glycol peut être utilisée pour déterminer la quantité de monoéthylène glycol nécessaire dans une application spécifique, telle que l’antigel pour un véhicule.
Formule d’éthylène glycol
La formule chimique de l’éthylène glycol est C2H6O2. La formule représente le nombre d’atomes de chaque élément dans une molécule d’éthylène glycol. La formule de l’éthylène glycol est importante pour déterminer ses propriétés, telles que son point d’ébullition, son point de fusion et sa densité. La formule peut également être utilisée pour calculer la quantité d’éthylène glycol nécessaire pour une application spécifique.
Point d’ébullition de l’éthylène glycol
Le monoéthylène glycol a un point d’ébullition de 197,3°C (387,1°F) à pression atmosphérique. Le point d’ébullition est la température à laquelle une substance passe de l’état liquide à l’état gazeux. Le point d’ébullition élevé du monoéthylène glycol en fait un liquide de refroidissement et un antigel efficace pour une utilisation dans les automobiles et d’autres applications.
Point de fusion de l’éthylène glycol
Le monoéthylène glycol a un point de fusion de -12,9°C (8,8°F). Le point de fusion est la température à laquelle une substance passe de l’état solide à l’état liquide. Le faible point de fusion du monoéthylène glycol lui permet de rester liquide à basse température, ce qui en fait un liquide de refroidissement efficace pour une utilisation dans les climats froids.
Densité de l’éthylène glycol g/mL
La densité du monoéthylène glycol est de 1,11 g/mL à 20°C (68°F). La densité est la mesure de la quantité de masse contenue dans un volume spécifique. La haute densité du monoéthylène glycol en fait un liquide de refroidissement et un antigel efficace pour une utilisation dans les automobiles et autres applications où l’espace est limité.
Éthylène Glycol Poids moléculaire
Le poids moléculaire du monoéthylène glycol est de 62,07 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire du monoéthylène glycol est important pour déterminer la quantité de monoéthylène glycol nécessaire pour une application spécifique, telle que l’antigel pour un véhicule.
Structure de l’éthylène glycol
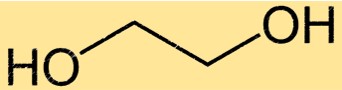
Le monoéthylène glycol a une structure chimique simple constituée de deux groupes hydroxyle attachés à une chaîne à deux carbones. La formule moléculaire du monoéthylène glycol est C2H6O2 et son nom IUPAC est éthane-1,2-diol. La structure simple du monoéthylène glycol en fait un solvant et un antigel efficaces pour une utilisation dans diverses applications.
| Apparence | Liquide clair et inodore |
| Gravité spécifique | 1,113 à 20°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 62,07 g/mole |
| Densité | 1,11 g/cm³ |
| Point de fusion | -12,9 °C (8,8 °F) |
| Point d’ébullition | 197,3°C (387,1°F) |
| Point d’éclair | 111°C (232°F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’acétone, les alcools, le benzène et l’éther |
| La pression de vapeur | 0,08 mmHg à 25°C |
| Densité de vapeur | 2,14 (air = 1) |
| pKa | 14,0 (premier), 13,2 (deuxième) |
| pH | Neutre |
Sécurité et dangers de l’éthylène glycol
Bien que le monoéthylène glycol ait de nombreuses applications pratiques, il présente également plusieurs risques pour la santé humaine et l’environnement. Le monoéthylène glycol est hautement toxique en cas d’ingestion et peut provoquer de graves problèmes de santé, notamment une insuffisance rénale, voire la mort. L’inhalation de vapeurs de monoéthylène glycol peut provoquer une irritation des voies respiratoires et du système nerveux central. Le monoéthylène glycol est également inflammable et peut réagir violemment avec certains produits chimiques. Il doit donc être manipulé avec prudence et stocké correctement. De plus, le monoéthylène glycol est nocif pour la vie aquatique et ne doit pas être rejeté dans les cours d’eau ou dans l’environnement. Des mesures de sécurité appropriées doivent être prises lors de la manipulation du monoéthylène glycol pour éviter les accidents et protéger la santé humaine et l’environnement.
| Symboles de danger | Crâne et os croisés, corrosif |
| Description de la sécurité | Ne pas ingérer. Eviter le contact avec la peau et les yeux. Utiliser avec une ventilation adéquate. Portez des gants de protection et des lunettes de protection. |
| Numéros d’identification de l’ONU | ONU 3082 |
| Code SH | 2905.32.00 |
| Classe de danger | 6.1 (toxique) |
| Groupe d’emballage | II |
| Toxicité | Très toxique en cas d’ingestion. Peut provoquer une insuffisance rénale et d’autres problèmes de santé graves. L’inhalation de vapeurs peut provoquer une irritation des voies respiratoires et des effets sur le système nerveux central. |
Méthodes de synthèse de l’éthylène glycol
Il existe plusieurs méthodes de synthèse du monoéthylène glycol, élément clé de nombreux processus industriels.
Une méthode courante est l’hydratation catalytique de l’oxyde d’éthylène , qui consiste à faire réagir l’oxyde d’éthylène avec de l’eau en présence d’un catalyseur, tel qu’un acide fort ou un oxyde métallique.
Une autre méthode consiste à hydrolyser le carbonate d’éthylène, qui se forme en faisant réagir l’oxyde d’éthylène avec le dioxyde de carbone.
Une autre façon de synthétiser le monoéthylène glycol consiste à oxyder l’éthylène. Le processus utilise un catalyseur à base d’oxyde d’argent pour oxyder l’éthylène, produisant de l’oxyde d’éthylène , qui subit ensuite une hydrolyse pour produire du monoéthylène glycol.
Pour synthétiser le monoéthylène glycol, on peut réduire l’acide oxalique avec de l’hydrogène, ce qui entraîne la production d’acide glycolique. Par la suite, la déshydratation de l’acide glycolique forme du monoéthylène glycol.
Utilisations de l’éthylène glycol
Le monoéthylène glycol a de nombreuses applications industrielles et commerciales, grâce à ses propriétés uniques et sa polyvalence. Certaines de ses principales utilisations comprennent :
- Antigel : Utilisé comme liquide de refroidissement et antigel dans les applications automobiles et industrielles. Son point de congélation bas et son point d’ébullition élevé en font un choix idéal pour prévenir les dommages au moteur dus au gel ou à la surchauffe.
- Agent de dégivrage : Utilisé comme agent de dégivrage pour les avions, les routes et les trottoirs, grâce à sa capacité à abaisser le point de congélation de l’eau.
- Solvant : Un solvant très efficace pour une large gamme de substances, notamment les résines, les huiles et les colorants. Les fabricants l’utilisent couramment dans la production de peintures, de revêtements et d’adhésifs.
- Humectant : Utilisé comme humectant dans les industries des cosmétiques et des soins personnels pour aider à prévenir la perte d’humidité dans les produits tels que les lotions et les shampoings.
- Intermédiaire chimique : utilisé comme intermédiaire clé dans la production d’une large gamme de produits chimiques, notamment les fibres et films de polyester, les polyuréthanes et les plastifiants.
- Fluide caloporteur : utilisé comme fluide caloporteur dans diverses applications industrielles, notamment les systèmes CVC, les capteurs solaires et les systèmes géothermiques.
Des questions:
Q : Qu’est-ce que l’éthylène glycol ?
R : Le monoéthylène glycol est un liquide clair, incolore, inodore et au goût sucré qui est couramment utilisé comme liquide de refroidissement et antigel dans les applications automobiles et industrielles. Il est également utilisé comme solvant, humectant et intermédiaire chimique dans diverses industries.
Q : Quelle est la pression de vapeur de l’éthylène glycol à son point d’ébullition normal ?
R : La pression de vapeur du monoéthylène glycol à son point d’ébullition normal de 197,3°C (387,1°F) est de 0,00131 atm.
Q : L’éthylène glycol est-il polaire ?
R : Oui, le monoéthylène glycol est une molécule polaire en raison de la présence de deux groupes fonctionnels -OH, qui créent un moment dipolaire et lui permettent de se dissoudre dans les solvants polaires.
Q : Comment mesurer le pH de l’éthylène glycol ?
R : Le pH du monoéthylène glycol peut être mesuré à l’aide d’un pH-mètre ou de bandelettes indicatrices de pH spécialement conçues pour être utilisées avec des solvants non aqueux. Il est important de noter que le monoéthylène glycol n’est pas une substance neutre, mais plutôt un acide faible avec un pH d’environ 6,5.
Q : Comment l’éthylène glycol affecte-t-il le corps ?
R : Le monoéthylène glycol peut être toxique s’il est ingéré ou absorbé par la peau, car il est métabolisé par le foie en sous-produits toxiques pouvant provoquer une insuffisance rénale, des convulsions et même la mort. Les symptômes d’une intoxication au monoéthylène glycol comprennent des maux de tête, des étourdissements, des nausées, des vomissements et de la confusion.
Q : Quelle formule représente le 1,2-éthanediol ?
R : La formule du 1,2-éthanediol, également connu sous le nom de monoéthylène glycol, est C2H6O2.
Q : Quelles sont les projections de Newman pour le 1,2-éthanediol ?
R : Les projections de Newman pour le 1,2-éthanediol montrent deux conformations décalées, avec les groupes -OH orientés dans une position éclipsée ou décalée les uns par rapport aux autres.
