L’éthylbenzène (C8H10) est un composé organique à l’odeur sucrée. Il est utilisé comme solvant dans diverses industries, notamment celles du plastique et du caoutchouc. On le retrouve également dans l’essence et entre dans la composition de certains produits ménagers.
| Nom UICPA | Éthylbenzène |
| Formule moléculaire | C8H10 |
| Numero CAS | 100-41-4 |
| Synonymes | Éthylbenzol, EB, phényléthane, éthylphényle, 2-phényléthane, alpha-méthyltoluène, 1-phényléthane, étilbenzène, diluant styrène |
| InChI | InChI=1S/C8H10/c1-2-8-6-4-3-5-7-8/h3-7H,2H2,1H3 |
Propriétés de l’éthylbenzène
Formule d’éthylbenzène
La formule moléculaire de l’éthylbenzène est C8H10, ce qui signifie qu’il se compose de huit atomes de carbone et de dix atomes d’hydrogène. La structure chimique de l’éthylbenzène comporte un cycle benzénique attaché à un groupe éthyle.
Éthylbenzène Masse molaire
La masse molaire de C8H10 est de 106,17 g/mol. Ceci est calculé en additionnant les masses atomiques de tous les atomes d’une molécule de C8H10.
Point d’ébullition de l’éthylbenzène
Le point d’ébullition du C8H10 est de 136,2 °C (277,2 °F). C’est la température à laquelle la forme liquide du C8H10 se transforme en gaz. Le C8H10 a un point d’ébullition relativement bas par rapport aux autres hydrocarbures aromatiques, ce qui le rend utile comme solvant dans diverses industries.
Éthylbenzène Point de fusion
Le point de fusion du C8H10 est de -95,2 °C (-139,4 °F). C’est la température à laquelle la forme solide du C8H10 se transforme en liquide. Le C8H10 a un point de fusion relativement bas par rapport aux autres hydrocarbures aromatiques, ce qui le rend utile comme matière première pour la production d’autres produits chimiques.
Densité d’éthylbenzène g/mL
La densité du C8H10 est de 0,867 g/mL à 20 °C (68 °F). Cela signifie qu’un millilitre de C8H10 pèse 0,867 gramme à cette température. Le C8H10 est moins dense que l’eau, ce qui signifie qu’il flottera à la surface de l’eau si les deux liquides sont mélangés.
Éthylbenzène Poids moléculaire
Le poids moléculaire du C8H10 est de 106,17 g/mol. Il s’agit de la masse d’une molécule de C8H10, qui peut être calculée en additionnant les masses atomiques de tous les atomes de la molécule.
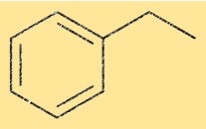
Structure de l’éthylbenzène
La structure de C8H10 est constituée d’un cycle benzénique lié à un groupe éthyle. Le groupe éthyle est attaché à l’un des atomes de carbone du cycle benzénique. Cette structure est également connue sous le nom de phényléthane.
Solubilité de l’éthylbenzène
C8H10 est insoluble dans l’eau mais soluble dans les solvants organiques tels que les alcools, les éthers et le chloroforme. Cela signifie que le C8H10 ne se dissoudra pas dans l’eau, mais qu’il se dissoudra dans d’autres liquides ayant des propriétés chimiques similaires. La solubilité du C8H10 dans divers solvants dépend de facteurs tels que la température, la pression et les propriétés chimiques du solvant.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,867 g/ml à 20°C |
| Couleur | Incolore |
| Odeur | Arôme doux |
| Masse molaire | 106,17 g/mole |
| Densité | 0,867 g/ml à 20°C |
| Point de fusion | -95,2°C (-139,4°F) |
| Point d’ébullition | 136,2°C (277,2°F) |
| Point d’éclair | 11,1°C (52°F) |
| Solubilité dans l’eau | 0,30 g/L à 20°C |
| Solubilité | Soluble dans les solvants organiques tels que les alcools, les éthers et le chloroforme |
| Pression de vapeur | 10,7 mmHg à 20°C |
| Densité de vapeur | 3.7 |
| pKa | 10.17 |
| pH | N’est pas applicable |
Sécurité et dangers de l’éthylbenzène
Le C8H10 peut être dangereux si les précautions appropriées ne sont pas prises lors de sa manipulation et de son utilisation. Il est classé comme liquide inflammable et peut s’enflammer s’il est exposé à la chaleur ou à une flamme. Le C8H10 peut également être nocif s’il est inhalé ou ingéré. L’exposition à des concentrations élevées de C8H10 peut provoquer des étourdissements, des maux de tête et une irritation respiratoire. L’exposition à long terme au C8H10 a été associée à des lésions du foie et des reins. Des mesures de sécurité doivent être prises lorsque vous travaillez avec le C8H10, comme porter des vêtements et des gants de protection, travailler dans des zones bien ventilées et le stocker dans un endroit sûr, frais et sec.
| Symboles de danger | Inflammable, nocif |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles, des flammes nues et des surfaces chaudes. Utilisez un équipement antidéflagrant. Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Bien se laver après manipulation. |
| Numéros d’identification de l’ONU | ONU 1175 |
| Code SH | 2902.90.20 |
| Classe de danger | 3 (Liquides inflammables) |
| Groupe d’emballage | II (Danger moyen) |
| Toxicité | L’éthylbenzène est considéré comme une substance modérément toxique. Il peut provoquer une irritation des yeux et de la peau, des problèmes respiratoires et des lésions du système nerveux si l’exposition est prolongée ou à des concentrations élevées. |
Méthodes de synthèse de l’éthylbenzène
La méthode la plus couramment utilisée pour synthétiser le C8H10 est la déshydrogénation catalytique de l’éthylcyclohexane. Ce processus consiste à chauffer un mélange d’éthylcyclohexane et d’hydrogène gazeux sur un catalyseur à haute température, ce qui provoque la séparation des atomes d’hydrogène du groupe éthyle, entraînant la formation de C8H10.
Une autre méthode de synthèse du C8H10 implique l’alkylation du benzène avec de l’éthylène gazeux. Cette réaction nécessite un catalyseur, généralement du chlorure d’aluminium, et entraîne la formation de C8H10 et de chlorure d’hydrogène comme sous-produit.
Une méthode alternative pour produire du C8H10 implique la réaction du benzène avec du chlorure d’éthyle en présence d’un catalyseur acide de Lewis, tel que le chlorure d’aluminium. Ce processus entraîne la formation de C8H10 et de chlorure d’hydrogène comme sous-produit.
Outre les méthodes mentionnées, les chercheurs développent également de nouvelles méthodes de synthèse du C8H10, telles que l’utilisation de liquides ioniques comme solvant pour l’alkylation de l’éthylène du benzène . Ces méthodes ont le potentiel d’offrir des avantages en termes d’efficacité et de durabilité environnementale. Cependant, leur utilisation industrielle n’est pas encore généralisée.
Utilisations de l’éthylbenzène
Le C8H10 a plusieurs utilisations importantes dans diverses industries. Certaines de ses principales utilisations sont :
- Production de styrène : La production de styrène, qui est utilisé pour fabriquer une variété de plastiques, de résines et de caoutchouc synthétique, repose sur le C8H10 comme intermédiaire clé.
- Solvant : Couramment utilisé comme solvant pour diverses applications, notamment les encres, les revêtements, les adhésifs et les produits de nettoyage.
- Additif pour carburant : ajouté à l’essence pour améliorer son indice d’octane, ce qui peut améliorer les performances du moteur.
- Intermédiaire chimique : utilisé comme matière première pour la synthèse d’autres produits chimiques, tels que le phényléthanol et le diéthylbenzène.
- Production de polymères : utilisé dans la production de divers types de polymères, tels que le polystyrène et les résines acrylonitrile-butadiène-styrène (ABS).
- Agriculture : Également utilisé comme pesticide et herbicide.
- Applications médicales : Utilisé comme anesthésique local, ainsi que comme solvant pour les produits pharmaceutiques.
Des questions:
Q : Combien de signaux vous attendriez-vous à voir dans le spectre RMN 1H pour l’éthylbenzène ?
R : Le spectre RMN 1H pour C8H10 aurait quatre signaux : deux pour les protons sur le cycle benzénique (qui apparaîtraient comme un doublet) et deux pour les protons sur le groupe éthyle (qui apparaîtraient comme un triplet).
Q : Quelles proportions de benzène et d’éthylbenzène doivent être mélangées ?
R : Les proportions de benzène et de C8H10 à mélanger dépendent de la concentration souhaitée de C8H10 dans le mélange. Le rapport benzène/C8H10 peut varier de 10:1 à 1:1, selon l’application.
Q : Qu’est-ce que la nitration de l’éthylbenzène ?
R : La nitration de C8H10 implique la réaction de C8H10 avec un mélange d’acide nitrique et d’acide sulfurique, entraînant l’introduction d’un ou plusieurs groupes nitro sur le cycle benzénique de C8H10. Cette réaction est couramment utilisée dans la production de produits chimiques industriels tels que le nitrobenzène et les phényléthylamines.
Q : L’éthylbenzène est-il polaire ?
R : C8H10 est un composé apolaire en raison de la structure symétrique du cycle benzénique, qui annule toute polarité du groupe éthyle. En conséquence, le C8H10 a une faible solubilité dans l’eau et est généralement soluble dans les solvants non polaires tels que l’hexane et le toluène.
Q : Comment passer de l’éthylbenzène au styrène ?
R : Le C8H10 peut être converti en styrène grâce au processus de déshydrogénation, qui implique l’élimination de deux atomes d’hydrogène du groupe éthyle à l’aide d’un catalyseur tel que l’oxyde de fer ou l’oxyde de chrome. Ce processus entraîne la formation de styrène et d’hydrogène gazeux comme sous-produit. Le styrène obtenu peut ensuite être purifié et utilisé dans la production de divers matériaux industriels tels que les plastiques, les résines et le caoutchouc synthétique.
