L’éthoxyde de sodium est une base forte formée par la réaction du sodium avec de l’éthanol. Il est utilisé en synthèse organique pour faciliter des réactions telles que l’estérification et la déprotonation.
| Nom UICPA | Éthoxyde de sodium |
| Formule moléculaire | C2H5NaO |
| Numero CAS | 141-52-6 |
| Synonymes | Éthanol, sel de sodium ; Éthylate de sodium ; Éthylsodium ; Éthylate ; Alcoolate éthylique de sodium |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Propriétés de l’éthoxyde de sodium
Formule d’éthoxyde de sodium
La formule chimique de l’éthylate de sodium est C2H5NaO. Il se compose de deux atomes de carbone (C), cinq atomes d’hydrogène (H), un atome de sodium (Na) et un atome d’oxygène (O). La formule représente le rapport des atomes présents dans une molécule d’éthylate de sodium.
Éthoxyde De Sodium Masse molaire
La masse molaire de l’éthylate de sodium est calculée en additionnant les masses atomiques de tous les atomes de sa formule. Le sodium (Na) a une masse molaire de 22,99 g/mol, le carbone (C) a une masse molaire de 12,01 g/mol, l’hydrogène (H) a une masse molaire de 1,01 g/mol et l’oxygène (O) a une masse molaire de 1,01 g/mol. masse de 16,00 g/mol. Leur addition donne une masse molaire d’environ 68,06 g/mol pour l’éthylate de sodium.
Point d’ébullition de l’éthoxyde de sodium
L’éthylate de sodium a un point d’ébullition d’environ 90-95°C (194-203°F). Cette température indique le point auquel l’éthylate de sodium passe d’une phase liquide à une phase gazeuse lorsqu’il est chauffé sous pression atmosphérique standard.
Point de fusion de l’éthoxyde de sodium
Le point de fusion de l’éthylate de sodium est d’environ 260-270°C (500-518°F). Cela signifie la température à laquelle l’éthylate de sodium solide passe à l’état liquide.
Densité d’éthoxyde de sodium g/mL
L’éthylate de sodium a une densité d’environ 0,868 g/mL. La densité fait référence à la masse d’une substance par unité de volume et peut être utilisée pour déterminer sa lourdeur ou sa légèreté relative par rapport à un volume égal d’eau.
Éthoxyde de Sodium Poids moléculaire
Le poids moléculaire de l’éthylate de sodium, également appelé masse moléculaire, est d’environ 68,06 g/mol. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans une molécule d’éthylate de sodium.
Structure de l’éthoxyde de sodium
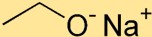
L’éthylate de sodium a une structure dans laquelle l’atome de sodium (Na) est lié à l’atome d’oxygène (O) par une liaison ionique. Le groupe éthoxyde, constitué de deux atomes de carbone (C) et de cinq atomes d’hydrogène (H), est attaché à l’atome de sodium.
Solubilité de l’éthoxyde de sodium
L’éthylate de sodium est hautement soluble dans les solvants polaires tels que l’éthanol (C2H5OH) et d’autres solvants organiques. Il se dissout facilement dans ces solvants pour former une solution claire et incolore, facilitant son utilisation comme réactif dans diverses réactions organiques.
| Apparence | Solide incolore |
| Gravité spécifique | 0,868 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 68,06 g/mole |
| Densité | 0,868 g/ml |
| Point de fusion | 260-270°C (500-518°F) |
| Point d’ébullition | 90-95°C (194-203°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau |
| Solubilité | Soluble dans l’éthanol (C2H5OH) et d’autres solvants organiques |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Basique (alcalin) |
Sécurité et dangers de l’éthoxyde de sodium
L’éthylate de sodium présente plusieurs risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. C’est une substance corrosive qui peut provoquer de graves brûlures de la peau, des yeux et du système respiratoire. Le contact direct doit être évité et des gants, des lunettes et des vêtements de protection doivent être portés. Il réagit violemment avec l’eau, libérant de l’hydrogène gazeux inflammable, et doit être conservé à l’abri de l’humidité. L’éthylate de sodium peut également réagir vigoureusement avec l’air, entraînant potentiellement un incendie ou une explosion. Une bonne ventilation est cruciale pour éviter l’accumulation de vapeurs. De plus, il est important de manipuler l’éthylate de sodium dans un laboratoire bien équipé avec du personnel formé pour minimiser les risques et garantir la sécurité.
| Symboles de danger | Corrosif |
| Description de la sécurité | – Provoque de graves brûlures<br>- Réagit violemment au contact de l’eau<br>- Conserver à l’abri de l’humidité<br>- Manipuler avec précaution<br>- Utiliser un équipement de protection<br>- Conserver dans un endroit sec<br>- Assurer une bonne ventilation |
| Numéros d’identification de l’ONU | UN2922 |
| Code SH | 2905.19.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation |
Méthodes de synthèse de l’éthoxyde de sodium
Plusieurs méthodes permettent de synthétiser l’éthylate de sodium.
Une façon de synthétiser l’éthylate de sodium implique la réaction entre le sodium métallique et l’éthanol . Le sodium métallique subit une réaction redox avec l’éthanol anhydre, entraînant la formation d’éthylate de sodium. Pour réaliser la réaction, on peut ajouter de petits morceaux de sodium métallique à de l’éthanol absolu et faire refluer le mélange dans des conditions contrôlées.
Une autre méthode implique la réaction entre l’hydroxyde de sodium (NaOH) et l’éthanol . On dissout l’hydroxyde de sodium dans l’éthanol et on chauffe le mélange, ce qui favorise la réaction pour donner de l’éthylate de sodium. Les chimistes utilisent couramment cette méthode lorsqu’ils ne préfèrent pas la réaction directe entre le sodium métallique et l’éthanol.
Comme alternative, ils peuvent préparer de l’éthylate de sodium en faisant réagir de l’éthanol avec du carbonate de sodium (Na2CO3). On dissout le carbonate de sodium dans l’éthanol , puis on chauffe et on agite le mélange. Ce processus conduit à la formation d’éthylate de sodium.
Il convient de noter que ces méthodes de synthèse nécessitent le strict respect des précautions de sécurité en raison de la réactivité des produits chimiques impliqués. Une manipulation appropriée des substances inflammables, l’utilisation d’équipements de protection et la conduite des réactions dans des zones bien ventilées sont essentielles pour la sécurité du personnel et la synthèse réussie de l’éthylate de sodium.
Utilisations de l’éthoxyde de sodium
L’éthylate de sodium trouve diverses applications en raison de sa réactivité et de sa forte nature basique. Voici quelques utilisations courantes :
- Synthèse organique : L’éthylate de sodium sert largement de base solide dans la synthèse organique. Il facilite les réactions telles que les processus d’estérification, de condensation et de déprotonation.
- Réactif alcoolate : il sert de réactif alcoolate, qui peut réagir avec divers composés organiques pour former des alcoxydes. Ces alcoolates sont des intermédiaires cruciaux dans de nombreuses réactions organiques.
- Catalyseur : L’éthylate de sodium agit comme catalyseur dans plusieurs réactions chimiques. Il favorise la conversion des composés organiques, tels que les alcools et les esters, en leurs éthers ou produits d’estérification correspondants.
- Agent de déshydratation : Il déshydrate les composés organiques en éliminant les molécules d’eau, facilitant ainsi la synthèse de produits anhydres.
- Polymérisation : L’éthylate de sodium participe aux réactions de polymérisation, notamment à la production de polyéthylène téréphtalate (PET) et d’autres polymères de polyester.
- Fabrication pharmaceutique : elle trouve des applications dans l’industrie pharmaceutique pour la synthèse de divers composés pharmaceutiques, notamment des esters, des éthers et des intermédiaires.
- Production de biodiesel : Le processus de transestérification utilise l’éthylate de sodium pour convertir les huiles végétales ou les graisses animales en biodiesel, un carburant renouvelable et respectueux de l’environnement.
- Réactif de laboratoire : les chercheurs utilisent couramment l’éthylate de sodium comme réactif pour les réactions organiques et dans les configurations expérimentales.
Des questions:
Q : L’éthoxyde de sodium est-il une base ?
R : Oui, l’éthylate de sodium est une base.
Q : L’éthoxyde de sodium est-il une base forte ou faible ?
R : L’éthylate de sodium est une base forte.
Q : À quoi vous attendriez-vous si de l’éthoxyde de sodium était ajouté à l’eau ?
R : Si de l’éthylate de sodium est ajouté à l’eau, il réagirait vigoureusement, libérant de l’hydrogène gazeux et formant de l’hydroxyde de sodium.
Q : L’éthoxyde de sodium est-il une base forte ou faible ?
R : L’éthylate de sodium est une base forte.
Q : L’éthoxyde de sodium est-il un nucléophile puissant ?
R : Oui, l’éthylate de sodium est un puissant nucléophile.
Q : Lequel des éléments suivants subit le plus facilement une réaction E2 avec l’éthoxyde de sodium ?
R : Le composé avec un groupe partant primaire ou secondaire subirait plus facilement une réaction E2 avec l’éthylate de sodium.
Q : L’éthoxyde de sodium est-il un nucléophile puissant ?
R : Oui, l’éthylate de sodium est un puissant nucléophile.
Q : L’éthoxyde de sodium est-il une base ?
R : Oui, l’éthylate de sodium est une base.
Q : Lequel des éléments suivants subit le plus facilement une réaction E2 avec l’éthoxyde de sodium (NaOCH2CH3) ?
R : Un composé avec un groupe partant primaire ou secondaire subirait plus facilement une réaction E2 avec l’éthylate de sodium.
Q : L’éthoxyde de sodium est-il inflammable ?
R : L’éthylate de sodium lui-même n’est pas inflammable, mais il réagit violemment avec l’eau, libérant de l’hydrogène gazeux inflammable.
Q : Qu’est-ce qui, combiné à l’éthanol, produit de l’éthoxyde de sodium et de l’hydrogène ?
R : La combinaison de sodium métallique et d’éthanol produit de l’éthylate de sodium et de l’hydrogène gazeux.
Q : À quoi vous attendriez-vous si de l’éthoxyde de sodium était ajouté à l’eau ?
R : Si de l’éthylate de sodium était ajouté à l’eau, il réagirait vigoureusement, libérant de l’hydrogène gazeux et formant de l’hydroxyde de sodium.
