L’éther diéthylique ou éthoxyéthane est un liquide incolore, hautement inflammable et volatil qui est couramment utilisé comme solvant et comme matière première pour la synthèse d’autres composés organiques.
| Nom UICPA | Éthoxyéthane |
| Formule moléculaire | C4H10O |
| Numero CAS | 60-29-7 |
| Synonymes | Éther, éther éthylique, oxyde d’éthyle, oxyde de diéthyle, 1,1′-oxybiséthane, déther, éther anesthésique, éther sulfurique, éther éthylique |
| InChI | InChI=1S/C4H10O/c1-3-5-4-2/h3-4H2,1-2H3 |
Propriétés de l’éther diéthylique
Densité de l’éther diéthylique g/ml
La densité de l’éther diéthylique est de 0,713 g/mL. La densité est définie comme la masse d’une substance par unité de volume. Dans le cas de l’éther diéthylique, sa densité est inférieure à celle de l’eau, qui a une densité de 1 g/mL. Cela signifie que l’éther diéthylique flotte à la surface de l’eau.
Éther diéthylique masse molaire
L’éther diéthylique a une masse molaire de 74,12 g/mol. La masse molaire est la masse d’une mole d’une substance, exprimée en grammes. Dans le cas de l’éthoxyéthane, une mole du composé en contient 74,12 grammes. Cette valeur est dérivée des masses atomiques de carbone, d’hydrogène et d’oxygène qui composent la molécule. La masse molaire d’une substance est un paramètre important dans les calculs chimiques, car elle est utilisée pour déterminer la quantité de substance présente dans un échantillon donné.
Structure de l’éther diéthylique
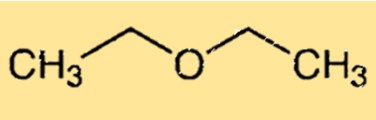
L’éther diéthylique a une structure chimique simple constituée de deux groupes éthyle attachés à un atome d’oxygène. La molécule a une forme courbée en raison de la paire isolée d’électrons sur l’atome d’oxygène qui provoque une distorsion de la molécule par rapport à la géométrie tétraédrique idéale. La structure courbée de l’éthoxyéthane est responsable de sa capacité à former des liaisons hydrogène avec d’autres molécules, ce qui en fait un solvant utile.
Point d’ébullition de l’éther diéthylique
Le point d’ébullition de l’éther diéthylique est de 34,6 °C (94,3 °F). Le point d’ébullition est la température à laquelle une substance passe de son état liquide à son état gazeux à pression atmosphérique. L’éther diéthylique a un point d’ébullition relativement bas, ce qui en fait un liquide volatil qui s’évapore facilement à température ambiante. Cette propriété le rend utile comme solvant et comme anesthésique en médecine.
Point de fusion de l’éther diéthylique
Le point de fusion de l’éthoxyéthane est de -116,3 °C (-177,3 °F). Le point de fusion est la température à laquelle une substance solide passe à l’état liquide à pression atmosphérique. L’éthoxyéthane est un liquide incolore à température ambiante, et il est rare de le voir à l’état solide en raison de son faible point de fusion.
Poids moléculaire de l’éther diéthylique
L’éthoxyéthane a un poids moléculaire de 74,12 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. C’est un paramètre important dans les réactions chimiques et la stœchiométrie car il détermine la quantité de réactif nécessaire pour former une quantité spécifique de produit.
Formule d’éther diéthylique
La formule chimique de l’éthoxyéthane est C4H10O. Il est composé de quatre atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. La formule représente le nombre exact de chaque type d’atome dans une molécule et est utilisée pour déterminer le poids moléculaire de la substance. La formule chimique d’une substance est essentielle dans les équations chimiques, où elle est utilisée pour équilibrer les réactions et déterminer la quantité de réactifs et de produits.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,713 |
| Couleur | Incolore |
| Odeur | Doux, semblable à l’éther |
| Masse molaire | 74,12 g/mole |
| Densité | 0,713 g/ml |
| Point de fusion | -116,3 °C (-177,3 °F) |
| Point d’ébullition | 34,6 °C (94,3 °F) |
| Point d’éclair | -45 °C (-49 °F) |
| Solubilité dans l’eau | 6,9 g/L à 25 °C |
| Solubilité | Miscible dans la plupart des solvants organiques |
| La pression de vapeur | 440 mmHg à 25 °C |
| Densité de vapeur | 2.5 |
| pKa | 15.9 |
| pH | 7 (neutre) |
Éther diéthylique Sécurité et dangers
L’éthoxyéthane comporte plusieurs considérations de sécurité et de danger qui doivent être prises en compte lors de sa manipulation. Il est hautement inflammable et peut former des mélanges vapeur-air explosifs. Il doit donc être tenu à l’écart des sources d’inflammation et des étincelles. Il peut également provoquer une irritation de la peau, des yeux et du système respiratoire, et une exposition prolongée peut provoquer des étourdissements et des maux de tête. Une ventilation adéquate est nécessaire lors de l’utilisation d’éthoxyéthane, et des équipements de protection tels que des gants et des lunettes doivent être portés. Il doit également être stocké dans un endroit frais et sec, à l’écart des agents oxydants et des matières incompatibles.
| Symboles de danger | F, Xi |
| Description de la sécurité | S9, S16, S29, S33, S60, S61 |
| Numéros d’identification de l’ONU | ONU 1155 |
| Code SH | 2909.19.00 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) : 3 500 mg/kg |
Méthodes de synthèse de l’éther diéthylique
Diverses méthodes existent pour synthétiser l’éther diéthylique, notamment la réaction de l’éthanol avec l’acide sulfurique et la déshydratation de l’éthanol à l’aide d’un agent déshydratant comme l’acide sulfurique ou l’alumine.
Pour synthétiser l’éthoxyéthane via la méthode de déshydratation, chauffez l’éthanol avec un agent déshydratant comme l’acide sulfurique ou l’alumine pour éliminer une molécule d’eau, formant ainsi de l’éthoxyéthane. Pour améliorer le rendement de la réaction, on peut utiliser un catalyseur tel que l’hydroxyde de potassium ou l’hydroxyde de sodium.
Une autre méthode de synthèse de l’éthoxyéthane consiste à synthétiser l’éther de Williamson, où l’éthanol réagit avec un ion alcoxyde tel que l’éthoxyde de sodium pour former de l’éthoxyéthane. Cette réaction nécessite l’utilisation d’une base forte et d’un solvant approprié, tel que l’éthanol anhydre.
Une autre méthode pour produire de l’éthoxyéthane consiste à utiliser la réaction de Tishchenko. Dans ce processus, l’acide acétique et l’éthanol réagissent en présence d’un catalyseur comme l’acide sulfurique ou l’oxyde d’aluminium, ce qui entraîne un rendement élevé en éthoxyéthane.
Pour produire de l’éthoxyéthane comme produit final, on peut utiliser du borohydrure de sodium ou de l’amalgame de sodium pour réduire l’acétaldéhyde. Il s’agit d’une autre méthode pour synthétiser l’éthoxyéthane. Cette réaction aboutit à la formation d’ éthanol , qui peut ensuite subir la méthode de déshydratation décrite ci-dessus pour former de l’éthoxyéthane.
Utilisations de l’éther diéthylique
Certaines utilisations de l’éther diéthylique comprennent :
- Solvant : Un solvant très efficace pour une gamme de composés organiques, notamment les huiles, les graisses, les résines et les cires. Utilisé dans la production de laques, vernis et autres revêtements.
- Anesthésique : Utilisé comme anesthésique pour les interventions chirurgicales, bien qu’il ait été largement remplacé par des alternatives plus sûres dans la médecine moderne.
- Extraction : Utilisé comme solvant d’extraction dans la production de produits pharmaceutiques, de produits naturels et d’huiles essentielles.
- Additif de carburant : utilisé comme additif de carburant pour améliorer les performances des moteurs diesel, car il peut augmenter l’indice de cétane du carburant.
- Intermédiaire chimique : intermédiaire clé dans la production d’une gamme de composés organiques, notamment l’éthanol, l’acétaldéhyde et l’acide acétique.
- Agent aromatisant : utilisé comme agent aromatisant dans la production de certains aliments et boissons, tels que les bonbons et les liqueurs.
- Réactif de laboratoire : Utilisé comme réactif dans les expériences de laboratoire, notamment en chimie organique.
- Propulseur d’aérosol : utilisé comme propulseur dans les produits en aérosol. Des problèmes de sécurité ont conduit à l’abandon progressif de cette utilisation.
Des questions:
Q : L’éther diéthylique est-il polaire ?
R : Oui, l’éthoxyéthane est une molécule polaire en raison de la présence de l’atome d’oxygène, qui crée une charge partielle négative à une extrémité de la molécule et une charge partielle positive à l’autre extrémité.
Q : L’éther diéthylique est-il miscible à l’eau ?
R : L’éthoxyéthane n’est pas très soluble dans l’eau. Cependant, il est considéré comme partiellement miscible à l’eau, ce qui signifie qu’il peut se mélanger à l’eau dans une certaine mesure mais pas complètement.
Q : L’éther diéthylique est-il inflammable ?
R : Oui, l’éthoxyéthane est hautement inflammable et peut former des mélanges explosifs avec l’air.
Q : L’éther diéthylique est-il polaire ou non polaire ?
R : L’éthoxyéthane est une molécule polaire en raison de la présence de l’atome d’oxygène.
Q : L’éther diéthylique est-il polaire aprotique ?
R : Oui, l’éthoxyéthane est considéré comme un solvant aprotique polaire, ce qui signifie qu’il peut dissoudre des molécules polaires mais ne possède pas d’atome d’hydrogène pouvant agir comme donneur de liaison hydrogène.
