L’EDTA est un acide aminé polycarboxylique qui peut chélater les ions métalliques. Il a la formule [CH2N(CH2CO2H)2]2. Il aide à éliminer les métaux lourds du corps. L’EDTA préserve également les échantillons de sang et les produits alimentaires.
| Nom Iupac | 2,2′,2 »,2 »’-(éthane-1,2-diyldiammonia)tétraacétate de disodium |
| Formule moléculaire | C10H14N2Na2O8 |
| Numero CAS | 139-33-3 |
| Synonymes | Sel disodique de l’acide (éthylènedinitrilo)tétraacétique, édétate disodique, EDTA disodique, édétate disodique, EDTA disodique, sel disodique de l’EDTA, sel disoïdique de l’éthylènebis (acide iminodiacétique), N,N’-1,2-éthanediylbis [N-(carboxyméthyl)glycine] , sel disodique, Na2-EDTA, Na2H2EDTA |
| Inchi | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Propriétés de l’EDTA
Formule EDTA
EDTA signifie acide éthylènediaminetétraacétique, qui est un composé organique synthétique capable de chélater les ions métalliques. La formule de l’EDTA est C10H16N2O8, ce qui signifie qu’il contient 10 atomes de carbone, 16 atomes d’hydrogène, 2 atomes d’azote et 8 atomes d’oxygène dans sa molécule.
EDTA Masse molaire
La masse molaire de l’édétate disodique est la somme des masses atomiques de tous les atomes de sa formule. Les masses atomiques du carbone, de l’hydrogène, de l’azote et de l’oxygène sont respectivement de 12,01 g/mol, 1,01 g/mol, 14,01 g/mol et 16,00 g/mol. Par conséquent, la masse molaire de l’édétate disodique est (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Point d’ébullition de l’EDTA
Le point d’ébullition d’une substance est la température à laquelle elle passe de l’état liquide à l’état gazeux. Le point d’ébullition de l’édétate disodique n’est pas facile à mesurer car il se décompose avant d’atteindre son point d’ébullition. Cependant, certaines sources estiment que le point d’ébullition de l’édétate disodique est d’environ 614,2 °C à une pression de 760 mmHg.
EDTA Point de fusion
Le point de fusion d’une substance est la température à laquelle elle passe de solide à liquide. Le point de fusion de l’édétate disodique dépend du degré d’hydratation et de cristallisation. La forme anhydre de l’édétate disodique a un point de fusion d’environ 240 °C, tandis que la forme dihydratée a un point de fusion d’environ 248 °C.
EDTA Densité g/ml
La densité d’une substance est la masse par unité de volume. La densité de l’édétate disodique varie également en fonction du degré d’hydratation et de cristallisation. La forme anhydre de l’édétate disodique a une densité d’environ 0,86 g/ml, tandis que la forme dihydratée a une densité d’environ 1,6 g/ml.
EDTA Poids moléculaire
Le poids moléculaire d’une substance est un autre terme désignant sa masse molaire, qui est la masse d’une mole de la substance. Comme mentionné ci-dessus, la masse molaire de l’édétate disodique est de 292,24 g/mol, son poids moléculaire est donc également de 292,24 g/mol.
Structure de l’EDTA
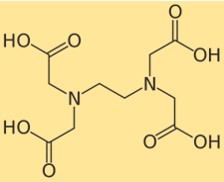
La structure de l’édétate disodique montre comment ses atomes sont disposés et liés dans sa molécule. L’édétate disodique possède un groupe central éthylènediamine auquel sont attachés quatre groupes acide carboxylique. Chaque groupe acide carboxylique peut perdre un proton et former une charge négative, qui peut se lier à un ion métallique. La structure de l’édétate disodique peut être représentée par le schéma suivant :
Solubilité de l’EDTA
La solubilité d’une substance est la quantité qui peut se dissoudre dans un solvant donné à une température et une pression données. La solubilité de l’édétate disodique dépend du pH et de la présence d’ions métalliques dans la solution. L’édétate disodique est plus soluble dans les solutions alcalines que dans les solutions acides car il forme davantage de charges négatives qui peuvent interagir avec les molécules d’eau. L’édétate disodique peut également former des complexes avec des ions métalliques, ce qui peut augmenter ou diminuer sa solubilité en fonction de la stabilité et de la charge du complexe. Par exemple, à pH 7 et 25 °C, la solubilité de l’édétate disodique dans l’eau est d’environ 0,5 M (186 mg/ml), tandis que la solubilité de son complexe calcique est d’environ 0,02 M (7 mg/ml).
| Apparence | Solide cristallin blanc |
| Densité spécifique | Pas disponible |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 292,24 g/mole |
| Densité | 1,6 g/ml (dihydraté), 0,86 g/ml (anhydre) |
| Point de fusion | 248 °C (dihydraté), 240 °C (anhydre) |
| Point d’ébullition | 614,2 °C (se décompose) |
| Point d’éclair | 325,2 °C |
| Solubilité dans l’eau | 0,5 M (186 mg/ml) à pH 7 et 25 °C |
| Solubilité | Soluble dans les solutions alcalines, insoluble dans les solvants organiques |
| Pression de vapeur | 3,77 x 10^-12 mmHg à 25 °C |
| Densité de vapeur | Pas disponible |
| pKa | 2.0, 2.7, 6.2, 10.3 |
| pH | 4 à 6 (solution 0,26 M) |
Risques pour la sécurité de l’EDTA
L’édétate disodique est un composé organique synthétique qui peut chélater les ions métalliques. Ses applications sont diverses dans les domaines de la médecine, de l’industrie, de l’agriculture et de la recherche. Cependant, il présente également certains risques pour la santé humaine et l’environnement s’il n’est pas manipulé correctement.
L’édétate disodique peut irriter la peau et les yeux s’il entre en contact avec eux. Il peut également provoquer des nausées, des vomissements, de la diarrhée et des douleurs abdominales en cas d’ingestion. Il peut nuire au système respiratoire en cas d’inhalation. Il peut affecter les cellules sanguines et les reins s’il est absorbé par l’organisme. Cela peut être mortel à fortes doses.
L’édétate disodique peut également contaminer le sol et l’eau s’il est rejeté dans l’environnement. Il peut se lier aux métaux essentiels et affecter leur disponibilité pour les plantes et les animaux. Il peut interférer avec les processus biologiques qui dépendent des ions métalliques.
Utilisez l’édétate disodique avec prudence et avec un équipement de protection approprié. Conservez-le dans un endroit frais, sec et bien ventilé. Jetez-le conformément aux réglementations locales.
| Symboles de danger | |
| Description de la sécurité | S24/25 : Éviter tout contact avec la peau et les yeux |
| Numéros d’identification de l’ONU | UN3077 (solide), UN3082 (liquide) |
| Code SH | 29224985 |
| Classe de danger | 9 (matières dangereuses diverses) |
| Groupe d’emballage | III (faible danger) |
| Toxicité | DL50 orale rat : 2000 mg/kg |
Méthodes de synthèse de l’EDTA
Il existe plusieurs méthodes pour synthétiser l’édétate disodique, mais la plus courante est la condensation de l’éthylènediamine avec l’acide chloroacétique ou son sel de sodium.
La réaction comporte deux étapes : premièrement, l’attaque nucléophile de l’éthylènediamine sur l’acide chloroacétique ou son sel de sodium forme un intermédiaire monoamide. Deuxièmement, l’élimination de l’acide chlorhydrique ou du chlorure de sodium forme un groupe acide carboxylique. Pour former de l’édétate disodique, on peut réagir avec un autre équivalent d’acide chloroacétique ou son sel de sodium.
Une autre méthode pour synthétiser l’édétate disodique est l’oxydation de l’éthylènediamine avec de l’hypochlorite de sodium dans une solution alcaline. Cette méthode produit de l’édétate disodique sous forme de sel de sodium et de l’ammoniac comme sous-produit.
D’autres méthodes pour synthétiser l’édétate disodique comprennent la réaction de l’éthylènediamine avec le formaldéhyde et le cyanure de sodium ou la réaction de l’éthylènediamine avec l’acide glyoxylique ou ses esters.
Utilisations de l’EDTA
L’édétate disodique est un composé organique synthétique qui peut chélater les ions métalliques. Il a diverses utilisations dans différents domaines et industries. Certaines des utilisations de l’édétate disodique sont :
- En médecine, l’édétate disodique peut traiter l’empoisonnement aux métaux lourds en se liant aux métaux toxiques et en les éliminant du corps. Il peut également prévenir la formation de caillots sanguins et la calcification des artères en chélatant les ions calcium.
- Dans les aliments et les boissons, l’édétate disodique peut préserver la couleur, la saveur et la texture des produits en empêchant l’oxydation et le rancissement. Il peut également empêcher la décoloration et la détérioration causées par les ions métalliques.
- Dans les cosmétiques et les soins personnels, l’édétate disodique peut améliorer la stabilité et l’efficacité des produits en empêchant la croissance microbienne et les réactions catalysées par les métaux. Il peut également améliorer l’apparence et la sensation des produits en chélatant les minéraux responsables de la dureté de l’eau.
- Dans l’industrie et la recherche, l’édétate disodique peut améliorer les performances et la qualité des produits et des processus en chélatant les ions métalliques qui interfèrent avec eux. Par exemple, il peut empêcher la formation de tartre dans les chaudières et les tuyaux, améliorer la teinture et l’impression des textiles, éliminer la rouille et les taches sur les métaux et contrôler le pH et la concentration en métaux dans les méthodes analytiques.
Des questions:
Q : Qu’est-ce que l’EDTA ?
R : l’édétate disodique est un composé organique synthétique qui peut chélater les ions métalliques. Il signifie acide éthylènediaminetétraacétique.
Q : Comment préparer une solution EDTA ?
R : Pour préparer une solution d’édétate disodique, pesez la quantité souhaitée d’édétate disodique et dissolvez-la dans de l’eau distillée. Ajustez le pH à 8,0 avec de l’hydroxyde de sodium.
Q : Comment dissoudre l’EDTA dans l’eau ?
R : l’édétate disodique est soluble dans l’eau, mais il se dissout lentement. Pour dissoudre l’édétate disodique dans l’eau, chauffez l’eau à environ 80 °C et remuez le mélange jusqu’à ce que l’édétate disodique se dissolve complètement.
Q : Comment préparer 0,5 M d’EDTA ?
R : Pour préparer de l’édétate disodique 0,5 M, pesez 73,06 g d’édétate disodique et dissolvez-le dans 800 ml d’eau distillée. Ajuster le pH à 8,0 avec de l’hydroxyde de sodium et diluer la solution à 1 L avec de l’eau distillée.
Q : Que fait l’EDTA ?
R : l’édétate disodique se lie aux ions métalliques et forme avec eux des complexes stables. Cela empêche les ions métalliques de réagir avec d’autres substances ou d’interférer avec les méthodes analytiques.
Q : Que signifie EDTA ?
R : édétate disodique signifie acide éthylènediaminetétraacétique, qui est le nom du composé de formule [CH2N(CH2CO2H)2]2.
Q : Comment calculer la dureté de l’eau par titrage EDTA ?
R : Pour calculer la dureté de l’eau par titrage à l’édétate disodique, titrez un volume connu d’échantillon d’eau avec une solution standard d’édétate disodique à l’aide d’un indicateur approprié. Enregistrez le volume d’édétate disodique utilisé et utilisez la formule suivante : Dureté (mg/L sous forme de CaCO3) = (Volume d’EDTA x Molarité de l’EDTA x 1000) / Volume d’échantillon d’eau
