Le disulfure de carbone est un composé chimique volatil formé en combinant du carbone et du soufre. Il est utilisé dans les processus industriels, les solvants et la fabrication de fibres de rayonne.
| Nom UICPA | Le disulfure de carbone |
| Formule moléculaire | CS2 |
| Numero CAS | 75-15-0 |
| Synonymes | Bisulfure de carbone, dithiocarbe, disulfure de carbone |
| InChI | InChI=1S/CS2/c2-1-3 |
Propriétés du disulfure de carbone
Formule de disulfure de carbone
La formule chimique du bisulfure de carbone est CS2. Il se compose d’un atome de carbone et de deux atomes de soufre, liés ensemble selon un arrangement linéaire. Cette formule simple est essentielle pour comprendre la composition de base du composé.
Disulfure De Carbone Masse molaire
La masse molaire du bisulfure de carbone est d’environ 76,14 g/mol. Pour calculer cela, nous additionnons les masses atomiques d’un atome de carbone (12,01 g/mol) et de deux atomes de soufre (32,06 g/mol chacun). Connaître la masse molaire aide à divers calculs chimiques.
Point d’ébullition du disulfure de carbone
Le bisulfure de carbone a un point d’ébullition relativement bas d’environ 46,3°C (115,3°F). Cette propriété le rend volatil et facilement vaporisable. Son faible point d’ébullition est important dans les procédés industriels et les applications nécessitant une évaporation rapide.
Point de fusion du disulfure de carbone
Le point de fusion du bisulfure de carbone est d’environ -110,8°C (-187,4°F). Il reste à l’état solide à des températures inférieures à ce point et passe à l’état liquide lorsqu’il est chauffé. Comprendre son point de fusion est crucial pour la manipulation et le stockage.
Densité du disulfure de carbone g/mL
La densité du bisulfure de carbone est d’environ 1,26 g/mL à température ambiante. Cette valeur signifie sa masse par unité de volume. Étant plus dense que l’eau, il coulera lorsqu’il sera mélangé et sa densité aura un impact sur sa solubilité dans divers solvants.
Disulfure de carbone Poids moléculaire
Le poids moléculaire du bisulfure de carbone est d’environ 76,14 g/mol, calculé à partir de sa formule chimique. Cette valeur joue un rôle essentiel dans la stœchiométrie et dans la détermination de la quantité de composé dans les réactions chimiques.
Structure du disulfure de carbone
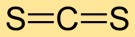
Le bisulfure de carbone a une structure moléculaire linéaire, avec l’atome de carbone au centre et des atomes de soufre de chaque côté. Cet arrangement simple est crucial pour comprendre son comportement chimique et ses interactions avec d’autres substances.
Solubilité du disulfure de carbone
Le bisulfure de carbone est peu soluble dans l’eau, avec seulement environ 0,2 g pour 100 ml d’eau à température ambiante. Cependant, il est très soluble dans les solvants organiques tels que le benzène et l’éthanol. Ce comportement de solubilité est essentiel pour diverses applications en chimie et en industrie.
| Apparence | Liquide incolore |
| Gravité spécifique | 1.26 |
| Couleur | Incolore |
| Odeur | Arôme piquant et sucré |
| Masse molaire | 76,14 g/mole |
| Densité | 1,26 g/ml |
| Point de fusion | -110,8°C (-187,4°F) |
| Point d’ébullition | 46,3°C (115,3°F) |
| Point d’éclair | -30°C (-22°F) |
| Solubilité dans l’eau | 0,2 g/100 ml (20 °C) |
| Solubilité | Soluble dans les solvants organiques comme le benzène et l’éthanol |
| La pression de vapeur | 318 mmHg (20 °C) |
| Densité de vapeur | 2,62 (air = 1) |
| pKa | ~ -2 |
| pH | Neutre (pH 7) |
Sécurité et dangers liés au sulfure de carbone
Le bisulfure de carbone présente des risques importants pour la sécurité. Il est hautement inflammable et ses vapeurs peuvent former des mélanges explosifs dans l’air. Une exposition prolongée peut provoquer des étourdissements, des maux de tête et même une perte de conscience. Il est également nocif pour la vie aquatique et l’environnement. Une ventilation adéquate, des équipements de protection individuelle et un stockage résistant au feu sont essentiels pour minimiser les risques. Évitez tout contact avec la peau et les yeux, car cela peut provoquer des irritations et des dommages. La manipulation doit avoir lieu dans des environnements bien contrôlés et les déversements doivent être contenus rapidement. Comprendre et respecter les consignes de sécurité sont essentiels pour prévenir les accidents et garantir un environnement de travail sûr lors de la manipulation du bisulfure de carbone.
| Symboles de danger | Inflammable, nocif |
| Description de la sécurité | Liquide et vapeurs hautement inflammables. Nocif en cas d’inhalation ou d’ingestion. Provoque une irritation de la peau et des yeux. |
| Numéros d’identification de l’ONU | UN1131 |
| Code SH | 2813.10.1000 |
| Classe de danger | 3 (Liquides inflammables) |
| Groupe d’emballage | II (Danger moyen) |
| Toxicité | Toxicité modérée |
Méthodes de synthèse du disulfure de carbone
Plusieurs méthodes actives permettent la synthèse du bisulfure de carbone.
Une méthode courante implique la réaction du soufre avec le méthane ou le gaz naturel à haute température, produisant du CS2 comme produit.
Une autre approche consiste à faire réagir la vapeur de soufre avec du charbon chaud. De plus, la combinaison de monoxyde de carbone et de vapeur de soufre sur un catalyseur peut également produire du bisulfure de carbone.
De plus, la synthèse directe du CS2 peut se produire lorsque le carbone réagit avec la vapeur de soufre à des températures élevées. En laboratoire, les chimistes utilisent la réaction entre le xanthate de potassium et l’acide sulfurique pour la production à plus petite échelle de bisulfure de carbone.
Chaque méthode nécessite des mesures de sécurité appropriées en raison de la nature hautement inflammable et toxique du bisulfure de carbone. La polyvalence de ces méthodes de synthèse permet diverses applications industrielles, notamment leur utilisation comme solvant, comme matière première dans les procédés chimiques et dans la fabrication de fibres de rayonne.
Utilisations du disulfure de carbone
Le bisulfure de carbone trouve diverses applications en raison de ses propriétés polyvalentes. Voici quelques-unes de ses utilisations :
- Applications de recherche et de laboratoire : les laboratoires utilisent le bisulfure de carbone comme réactif pour diverses réactions chimiques, y compris la synthèse de composés organométalliques.
- Extraction des huiles essentielles : Le bisulfure de carbone trouve une application dans l’extraction des huiles essentielles des plantes, facilitant la séparation des composés aromatiques souhaités.
- Extraction d’huile : les industries utilisent le bisulfure de carbone pour extraire les huiles des graines et des légumes en raison de sa solubilité et de son faible point d’ébullition.
- Fabrication de fibres de rayonne : le bisulfure de carbone joue un rôle essentiel dans la production de fibres de rayonne, car il aide à dissoudre la cellulose, que les fabricants extrudent ensuite pour former des fibres synthétiques utilisées dans les textiles.
- Applications industrielles : Le bisulfure de carbone contribue à la production de pesticides, de fumigants et de produits chimiques à base de caoutchouc. De plus, il agit comme catalyseur dans la fabrication d’acide sulfurique et de tétrachlorure de carbone.
- Solvant : Le bisulfure de carbone sert de solvant à diverses substances, notamment les huiles, les graisses, le caoutchouc, les résines et le soufre. En conséquence, il est couramment utilisé dans la production de produits à base de cellulose.
- Processus chimiques : Il sert de matière première dans la synthèse de composés organiques tels que le tétrachlorure de carbone, les thiocarbamates et les dithiocarbamates. Ces composés trouvent des applications dans les industries agricoles et pharmaceutiques.
- Vulcanisation du caoutchouc : Le bisulfure de carbone participe au processus de vulcanisation du caoutchouc, améliorant sa résistance, son élasticité et sa résistance à l’usure.
Ces diverses applications mettent en évidence l’importance du bisulfure de carbone dans de multiples industries, allant du textile à l’agriculture, en passant par la recherche et la fabrication.
Des questions:
Q : Laquelle des molécules suivantes est polaire ? un. ammoniac B. octane c. l’eau d. le disulfure de carbone
R : a, l’eau (H2O) est polaire en raison de sa forme moléculaire courbée et du partage inégal des électrons.
Q : Quel est l’angle entre les liaisons carbone-soufre dans la molécule de disulfure de carbone (CS2) ?
R : L’angle entre les liaisons carbone-soufre dans CS2 est de 180 degrés, formant une géométrie linéaire.
Q : Combien d’atomes au total contient 1 mole de sulfure de carbone ?
R : Une mole de bisulfure de carbone contient 6,02 x 10^23 molécules, et chaque molécule possède 3 atomes (1 carbone et 2 soufre).
Q : Selon vous, lequel de ces éléments serait soluble dans le solvant non polaire, le disulfure de carbone, CS2 ?
R : Les substances non polaires comme l’octane (b) devraient être solubles dans le bisulfure de carbone (CS2).
Q : Quel est le point d’ébullition normal du sulfure de carbone ?
R : Le point d’ébullition normal du bisulfure de carbone est d’environ 46,3°C (115,3°F).
Q : Le disulfure de carbone est-il polaire ou non polaire ?
R : Le bisulfure de carbone (CS2) est une molécule non polaire en raison de sa forme linéaire et du partage égal des électrons.
Q : Quelle est la formule du disulfure de carbone ?
R : La formule du bisulfure de carbone est CS2.
Q : Qu’est-ce que le disulfure de carbone ?
R : Le bisulfure de carbone (CS2) est un composé chimique volatil composé d’un atome de carbone et de deux atomes de soufre, utilisé dans diverses applications industrielles.
Q : Quelle est l’importance du fait que le sulfure de carbone est plus dense que l’eau ?
R : La densité plus élevée du bisulfure de carbone par rapport à l’eau signifie qu’il ne se mélangera pas facilement et formera des couches distinctes une fois combiné.
Q : Comment les humains peuvent-ils rencontrer du disulfure de carbone ?
R : Les humains peuvent entrer en contact avec le bisulfure de carbone par le biais de processus industriels, d’applications chimiques ou de la manipulation de certains produits.
Q : Que se passe-t-il si vous ingérez du disulfure de carbone ?
R : L’ingestion de bisulfure de carbone peut entraîner des problèmes de santé, notamment des nausées, des maux de tête et des effets sur le système nerveux, ce qui le rend dangereux pour la santé humaine.
Q : Le disulfure de carbone est-il plus dense que l’eau ?
R : Oui, le bisulfure de carbone est plus dense que l’eau, avec une densité d’environ 1,26 g/mL par rapport à la densité de l’eau de 1 g/mL.
