La diméthylamine (DMA) est un composé chimique ayant une odeur de poisson. Il est utilisé dans divers processus industriels, tels que la production de produits chimiques agricoles, de produits pharmaceutiques et de tensioactifs.
| Nom de l’UICPA | N-méthylméthanamine |
| Formule moléculaire | C2H7N |
| Numero CAS | 124-40-3 |
| Synonymes | DMA, N-méthylméthanamine, diméthylammoniac, méthylamine, N-méthylméthanamine, N-méthylméthanamine, chlorhydrate de N-méthylméthanamine |
| InChI | InChI=1S/C2H7N/c1-3-2/h3H,1-2H3 |
Propriétés de la diméthylamine
Formule de diméthylamine
La diméthylamine est un composé organique de formule chimique C2H7N. C’est un dérivé de l’ammoniac, dont deux des trois atomes d’hydrogène ont été remplacés par des groupes méthyle. Sa formule représente la composition d’une molécule de diméthylamine, qui contient deux atomes de carbone, sept atomes d’hydrogène et un atome d’azote.
Diméthylamine Masse molaire
La masse molaire du DMA est de 45,09 g/mol. Il s’agit d’une molécule relativement petite, ce qui contribue à son faible point d’ébullition et à sa pression de vapeur élevée. La masse molaire est la masse d’une mole de DMA et est calculée en additionnant les masses atomiques de tous les atomes de la molécule.
Point d’ébullition de la diméthylamine
Le point d’ébullition du DMA est de -6,3°C. Ce faible point d’ébullition fait du DMA un liquide volatil et inflammable. Il bout à une température plus basse que l’eau, ce qui signifie qu’il peut facilement s’évaporer lorsqu’il est exposé à l’air. Le point d’ébullition d’une substance est la température à laquelle elle passe de l’état liquide à l’état gazeux.
Diméthylamine Point de fusion
Le point de fusion du DMA est de -92°C. C’est un liquide incolore à température ambiante mais peut geler pour former un solide cristallin blanc en dessous de son point de fusion. Le point de fusion d’une substance est la température à laquelle elle passe d’un solide à un liquide.
Diméthylamine Densité g/mL
La densité du DMA est de 0,67 g/mL. Elle est moins dense que l’eau, qui a une densité de 1 g/mL. Cela signifie que le DMA flottera sur l’eau. La densité d’une substance est la masse par unité de volume de la substance.
Diméthylamine Poids moléculaire
Le poids moléculaire du DMA est de 45,09 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule de DMA. Le poids moléculaire est utile pour déterminer la quantité d’une substance nécessaire pour produire un certain volume ou une certaine concentration d’une solution.
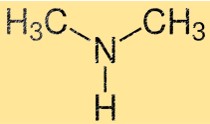
Structure de la diméthylamine
La structure du DMA est constituée d’un atome d’azote lié à deux groupes méthyle et à un atome d’hydrogène. C’est une simple amine primaire de forme pyramidale. L’atome d’azote possède une paire d’électrons non liants, ce qui fait du DMA une base faible.
Solubilité de la diméthylamine
Le DMA est soluble dans l’eau, l’éthanol et l’éther diéthylique. Il forme des liaisons hydrogène avec les molécules d’eau, ce qui lui permet de se dissoudre facilement dans l’eau. Sa solubilité dans les solvants organiques tels que l’éthanol et l’éther diéthylique est due à sa capacité à former des liaisons hydrogène intermoléculaires avec les molécules du solvant.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,666 g/ml à 25°C |
| Couleur | Incolore |
| Odeur | Poisson, ammoniac |
| Masse molaire | 45,09 g/mole |
| Densité | 0,666 g/ml à 25°C |
| Point de fusion | -92°C |
| Point d’ébullition | -6,3°C |
| Point d’éclair | -32°C |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol et l’éther diéthylique |
| La pression de vapeur | 522 mmHg à 20°C |
| Densité de vapeur | 1,53 (air = 1) |
| pKa | 10.73 |
| pH | 11.1 |
Sécurité et dangers de la diméthylamine
Le DMA peut être dangereux s’il n’est pas manipulé correctement. Il est hautement inflammable et peut s’enflammer facilement en présence de chaleur, d’étincelles ou de flammes. Il est également toxique et peut provoquer une irritation des yeux, de la peau et du système respiratoire. L’exposition directe au DMA peut entraîner des maux de tête, des étourdissements et des nausées. Il est important d’utiliser des équipements de protection tels que des gants, des lunettes et des respirateurs lors de la manipulation du DMA. Il doit être conservé dans un endroit frais et sec, à l’écart de la chaleur et des sources d’ignition. En cas de déversement ou d’exposition, il doit être manipulé conformément aux protocoles de sécurité appropriés.
| Symboles de danger | F, T |
| Description de la sécurité | Facilement inflammable, toxique, corrosif |
| Numéros d’identification de l’ONU | ONU 1032 |
| Code SH | 2921.19.00 |
| Classe de danger | 2.1 (Gaz inflammable) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) 230 mg/kg ; CL50 (inhalation, rat) 1660 ppm/4h |
Méthodes de synthèse de la diméthylamine
Plusieurs méthodes existent pour synthétiser le DMA.
Une méthode courante consiste à faire réagir le méthanol et l’ammoniac en présence d’un catalyseur. Les chimistes peuvent distiller et purifier le produit obtenu pour obtenir du DMA pur.
Une autre méthode implique la réaction du formaldéhyde et du chlorure d’ammonium en présence d’une base, telle que l’hydroxyde de sodium. La réaction produit de la méthylamine, et on peut ensuite réagir avec du formaldéhyde pour donner du DMA.
Pour synthétiser le DMA, on peut réagir avec du sulfate de diméthyle et de l’ammoniac . Cette réaction est exothermique et produit du DMA et du sulfate d’ammonium comme sous-produits. Cependant, les chimistes n’utilisent pas couramment cette méthode en raison de la nature dangereuse du sulfate de diméthyle.
Pour obtenir du DMA, on peut faire réagir du chlorure de méthyle avec de l’ammoniac . Cette réaction produit également du chlorure d’ammonium comme sous-produit.
Dans l’ensemble, la synthèse du DMA nécessite une manipulation soigneuse et l’utilisation d’équipements et d’équipements de protection appropriés en raison de la nature dangereuse des matières premières et des conditions de réaction.
Utilisations de la diméthylamine
Le DMA a un large éventail d’applications dans diverses industries en raison de ses propriétés chimiques uniques. Voici quelques-unes des utilisations courantes du DMA :
- Industrie agricole : Divers herbicides, insecticides et fongicides utilisent la DEA comme intermédiaire dans leur production.
- Produits pharmaceutiques : utilisés comme matière première pour la synthèse de divers produits pharmaceutiques, notamment des anesthésiques locaux, des antibiotiques et des antihistaminiques.
- Industrie du caoutchouc : utilisé comme accélérateur de vulcanisation dans l’industrie du caoutchouc, ce qui améliore les propriétés physiques des produits en caoutchouc.
- Industrie pétrolière : Utilisé comme inhibiteur de corrosion et agent neutralisant dans le raffinage du pétrole.
- Traitement de l’eau : Utilisé comme floculant dans le traitement de l’eau pour éliminer les matières en suspension et autres impuretés.
- Solvant : utilisé comme solvant dans la production de divers produits chimiques, notamment des résines, des colorants et des plastiques.
- Industrie textile : Utilisé comme intermédiaire de teinture et comme agent de finition dans l’industrie textile.
- Soins personnels : Également utilisé comme ingrédient dans divers produits de soins personnels, notamment les shampooings et les revitalisants, car il agit comme ajusteur de pH.
Des questions:
Q : Lequel des énoncés suivants représente la neutralisation complète de la diméthylamine ?
R : La neutralisation complète du DMA se produit lorsqu’il réagit avec l’acide chlorhydrique pour former du chlorure de diméthylammonium et de l’eau.
Q : Quel type de produit se produit lorsque la 3-pentanone réagit avec la diméthylamine ?
R : Lorsque la 3-pentanone réagit avec le DMA, le produit résultant est une imine.
Q : La diméthylamine est-elle sans danger pour les cheveux ?
R : Le DMA est couramment utilisé dans les produits de soins capillaires comme ajusteur de pH et est considéré comme sûr pour une utilisation à faibles concentrations.
Q : La diméthylamine est-elle bonne pour les cheveux ?
R : Le DMA peut être bénéfique pour les cheveux lorsqu’il est utilisé dans des produits de soins capillaires à des concentrations appropriées, car il peut contribuer à améliorer l’efficacité d’autres ingrédients.
Q : Qu’est-ce que la diméthylamine ?
R : Le DMA est un composé organique de formule chimique (CH3)2NH. C’est un gaz incolore à forte odeur et couramment utilisé dans divers procédés industriels.
Q : La diméthylamine est-elle une base ?
R : Le DMA est une base faible, car elle peut accepter un proton d’une molécule d’eau pour former un ion hydroxyde et un ion méthylammonium.
Q : La cétéaryl diméthylamine est-elle une fille bouclée ?
R : Cetearyl DMA n’est pas considéré comme approuvé par les filles bouclées, car il s’agit d’un ingrédient synthétique couramment utilisé dans les produits de soins capillaires et peut ne pas convenir à celles qui suivent la méthode des filles bouclées.
Q : Comment trouver le pka de la diméthylamine ?
R : Le pKa du DMA peut être trouvé expérimentalement en mesurant le pH d’une solution de concentration connue de DMA et de son acide conjugué, et en utilisant l’équation de Henderson-Hasselbalch pour calculer la valeur du pKa.
Q : Comment prépareriez-vous 100 ml d’un tampon avec un pH de 11,0 à partir de diméthylamine ?
R : Pour préparer un tampon avec un pH de 11,0 à partir de DMA, il faudrait mélanger une certaine quantité de DMA avec son acide conjugué, le chlorure de diméthylammonium, dans un rapport spécifique pour obtenir le pH souhaité. Les quantités exactes dépendront de la capacité tampon souhaitée et du pKa de l’acide conjugué.
