La diéthylamine (DEA) est un composé chimique qui dégage une forte odeur semblable à celle de l’ammoniac. Il est utilisé dans la production de pesticides, de produits pharmaceutiques et d’accélérateurs de caoutchouc. Cela peut provoquer une irritation de la peau, des yeux et du système respiratoire.
| Nom UICPA | N,N-diéthylméthanamine |
| Formule moléculaire | C4H11N |
| Numero CAS | 109-89-7 |
| Synonymes | N-éthyl-éthanamine, DEA, diéthylamino, N,N-diéthylamine, N-éthyléthanamine, diéthylamine |
Propriétés de la diéthylamine
Formule de diéthylamine
La formule de la diéthylamine est C4H11N. C’est une amine aliphatique primaire avec deux groupes éthyle attachés à l’atome d’azote. La structure moléculaire de la diéthylamine contient un atome d’azote central lié à deux groupes éthyle et à un atome d’hydrogène.
Diéthylamine Masse molaire
La masse molaire de la DEA est de 73,14 g/mol. Ceci est calculé en additionnant les masses atomiques de tous les atomes présents dans une molécule de DEA. La masse molaire est un paramètre important utilisé pour calculer la quantité de DEA nécessaire pour une réaction chimique donnée.
Point d’ébullition de la diéthylamine
Le point d’ébullition de la DEA est de 55,8°C. Cela signifie qu’à cette température, la forme liquide de la DEA commencera à se vaporiser et à se transformer en gaz. Le point d’ébullition est un paramètre important qui détermine les conditions requises pour qu’une réaction chimique ait lieu.
Diéthylamine Point de fusion
Le point de fusion du DEA est de -49,8°C. Cela signifie qu’à cette température, la forme solide du DEA commencera à fondre et à se transformer en liquide. Le point de fusion est un paramètre important utilisé pour déterminer la pureté du DEA.
Diéthylamine Densité g/mL
La densité de la DEA est de 0,707 g/mL. Cela signifie qu’un millilitre de DEA pèse 0,707 gramme. La densité est un paramètre important utilisé pour calculer la quantité de DEA nécessaire pour une réaction chimique donnée.
Diéthylamine Poids moléculaire
Le poids moléculaire de la DEA est de 73,14 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule de DEA. Le poids moléculaire est un paramètre important utilisé pour calculer la quantité de DEA requise pour une réaction chimique donnée.
Structure de la diéthylamine
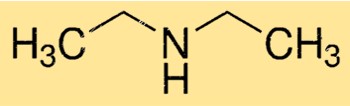
La DEA a une structure moléculaire linéaire, avec l’atome d’azote central lié à deux groupes éthyle et à un atome d’hydrogène. La molécule a une forme pyramidale trigonale en raison de la paire d’électrons libres sur l’atome d’azote. Cette structure est importante pour déterminer la réactivité et les propriétés de la DEA.
Solubilité de la diéthylamine
La DEA est soluble dans l’eau et dans de nombreux solvants organiques. Son pKa est de 10,75, ce qui signifie qu’il s’agit d’une base faible. La solubilité de la DEA dépend de facteurs tels que la température, le pH et la polarité du solvant. Sa solubilité dans l’eau est de 100 g/L à 25°C.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,707 g/ml |
| Couleur | Incolore |
| Odeur | Similaire à l’ammoniaque |
| Masse molaire | 73,14 g/mole |
| Densité | 0,707 g/ml |
| Point de fusion | -49,8°C |
| Point d’ébullition | 55,8°C |
| Point d’éclair | -15°C |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans de nombreux solvants organiques |
| Pression de vapeur | 94,7 mmHg à 25°C |
| Densité de vapeur | 2.5 |
| pKa | 10h75 |
| pH | Basique |
Sécurité et dangers de la diéthylamine
La DEA peut être dangereuse pour la santé humaine si elle n’est pas manipulée correctement. Il est corrosif et peut provoquer une irritation de la peau, des yeux et des voies respiratoires au contact. Une exposition prolongée à la DEA peut causer des dommages au foie et aux reins. Il est inflammable et peut former des mélanges explosifs avec l’air. Des précautions particulières telles qu’une ventilation adéquate, un équipement de protection individuelle et des conteneurs de stockage résistants au feu doivent être prises lors de la manipulation du DEA. En cas d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés. Il est important de suivre toutes les directives et protocoles de sécurité lorsque vous travaillez avec DEA pour assurer votre sécurité et celle des autres.
| Symboles de danger | Corrosif, Inflammable |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles, des flammes nues et des surfaces chaudes. Évitez de respirer les vapeurs, les brouillards ou les gaz. Portez des gants de protection, des lunettes de protection et une protection du visage. Utiliser dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | ONU 1154 |
| Code SH | 29211990 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Peut provoquer une irritation de la peau, des yeux et des voies respiratoires. Une exposition prolongée peut causer des dommages au foie et aux reins. |
Méthodes de synthèse de la diéthylamine
Il existe plusieurs méthodes pour synthétiser la DEA, notamment la réaction de l’éthanol et de l’ammoniac ou la réaction du sulfate de diéthyle et de l’ammoniac.
Une méthode consiste à chauffer un mélange d’ éthanol et d’ammoniac en présence d’un catalyseur, tel que de l’alumine ou du gel de silice. La réaction produit de la DEA et de l’eau, qui peuvent être séparées par distillation.
Une autre méthode implique la réaction du sulfate de diéthyle avec l’ammoniac . La réaction a lieu dans un solvant, tel que le méthanol ou l’éthanol, et produit du sulfate de DEA. Pour produire de la DEA et du sulfate de sodium, on peut traiter le sulfate de DEA avec une base forte, telle que l’hydroxyde de sodium.
Pour synthétiser la DEA, on peut faire réagir l’éthylène avec de l’ammoniac en présence d’un catalyseur, tel que l’oxyde de fer. La réaction produit un mélange de DEA et de triéthylamine, qui peut être séparé par distillation.
Lors de la synthèse de la DEA, il faut faire preuve de prudence car les réactifs et les produits peuvent présenter des risques pour la santé humaine et l’environnement. Par conséquent, il est nécessaire d’utiliser des mesures et des équipements de sécurité appropriés pendant le processus de synthèse.
Utilisations de la diéthylamine
La DEA a plusieurs utilisations dans différentes industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations courantes :
- Produits pharmaceutiques : utilisés comme élément de base dans la synthèse de produits pharmaceutiques, tels que les anesthésiques locaux et les antihistaminiques.
- Produits chimiques agricoles : utilisés comme matière première dans la production d’herbicides, comme le glyphosate.
- Industrie du caoutchouc : Utilisé dans la production d’accélérateurs pour la vulcanisation du caoutchouc.
- Industrie des colorants : utilisée dans la production de colorants et de pigments, tels que les colorants acides et les colorants réactifs.
- Inhibiteurs de corrosion : Utilisés comme inhibiteurs de corrosion dans l’industrie pétrolière pour protéger les pipelines et les réservoirs de stockage de la corrosion.
- Solvants : Utilisés comme solvant dans la production de résines synthétiques et de polymères.
- Synthèse chimique : Également utilisé comme réactif dans une large gamme de réactions de synthèse chimique.
Des questions:
Q : Qu’est-ce qui est le plus basique, la triéthylamine ou la diéthylamine ?
R : La triéthylamine est plus basique que la DEA en raison de sa plus grande taille et de la présence de trois groupes éthyle qui contribuent à augmenter la densité électronique.
Q : Quel est le pH de la diéthylamine 0,10 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4) ?
R : Le pH d’une solution de DEA 0,10 M peut être calculé à l’aide de la valeur Kb et de l’équation de la constante de dissociation des bases. Le pH de la solution est d’environ 10,49.
Q : Quel est le pH de la diéthylamine 0,11 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4) ?
R : Le pH d’une solution de DEA 0,11 M peut être calculé à l’aide de la valeur Kb et de l’équation de la constante de dissociation des bases. Le pH de la solution est d’environ 10,50.
Q : Quelle est l’enthalpie standard de formation de diéthylamine liquide, (CH3CH2)2NH ?
R : L’enthalpie standard de formation de DEA liquide est de -42,52 kJ/mol.
Q : La diéthylamine est-elle polaire ?
R : Oui, la DEA est polaire en raison de la présence d’un atome d’azote avec une paire d’électrons libres et de la différence d’électronégativité entre l’azote et le carbone.
Q : Qu’est-ce qui est le plus basique, la diéthylamine ou la triéthylamine ?
R : La triéthylamine est plus basique que la DEA en raison de la présence de trois groupes éthyle qui contribuent à augmenter la densité électronique.
Q : Quel est le pH d’une solution de diéthylamine 0,10 M ?
R : Le pH d’une solution de DEA 0,10 M peut être calculé à l’aide de la valeur Kb et de l’équation de la constante de dissociation des bases. Le pH de la solution est d’environ 10,49.
Q : La diéthylamine est-elle un acide fort ou faible ?
R : Le DEA est une base faible, pas un acide fort. Il réagit avec l’eau pour produire des ions hydroxyde et des ions diéthylammonium.
