Le dichlorure de soufre (SCl₂) est un composé chimique formé en combinant du soufre et du chlore. Il est utilisé dans diverses industries pour fabriquer des colorants, du caoutchouc et des pesticides.
| Nom UICPA | Dichlorure de soufre |
| Formule moléculaire | SCl₂ |
| Numero CAS | 10545-99-0 |
| Synonymes | Monosulfure de chlore, chlorure sulfureux, dichlorure de soufre, chlorure de soufre, dichlorosulfane |
| InChI | InChI=1S/Cl2S/c1-3-2 |
Propriétés du dichlorure de soufre
Formule de dichlorure de soufre
La formule du chlorure de soufre est SCl₂. Il représente la combinaison d’un atome de soufre et de deux atomes de chlore. Cette formule chimique reflète fidèlement la composition et la structure du composé.
Dichlorure De Soufre Masse molaire
La masse molaire du chlorure de soufre peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le soufre a une masse molaire de 32,06 g/mol et le chlore a une masse molaire de 35,45 g/mol. En additionnant les masses de deux atomes de chlore et d’un atome de soufre, la masse molaire du chlorure de soufre est déterminée comme étant d’environ 102,91 g/mol.
Point d’ébullition du dichlorure de soufre
Le chlorure de soufre a un point d’ébullition de 138,8 °C (281,8 °F). Cette température indique le point auquel le composé liquide passe à l’état gazeux sous pression atmosphérique standard. Il est important de prendre en compte le point d’ébullition du chlorure de soufre lors de sa manipulation ou de son utilisation dans diverses applications.
Dichlorure de soufre Point de fusion
Le point de fusion du chlorure de soufre est de -76,8 °C (-106,2 °F). Cette température représente le point auquel le composé solide passe à l’état liquide. Il est essentiel de connaître le point de fusion lorsque l’on travaille avec du chlorure de soufre afin de garantir une manipulation et un stockage appropriés.
Densité du dichlorure de soufre g/mL
Le chlorure de soufre a une densité d’environ 1,64 g/mL. La valeur de densité indique la quantité de masse par unité de volume de la substance. Cette propriété est essentielle pour comprendre le comportement et les caractéristiques du chlorure de soufre dans différents contextes, comme lors de réactions chimiques ou pour déterminer son adéquation à des applications spécifiques.
Dichlorure De Soufre Poids moléculaire
Le poids moléculaire du chlorure de soufre est d’environ 102,91 g/mol. Il représente la masse totale d’une molécule du composé, calculée en additionnant les masses atomiques de ses éléments constitutifs. Le poids moléculaire fournit des informations précieuses sur la masse du composé et permet des mesures précises dans divers calculs chimiques.
Structure du dichlorure de soufre
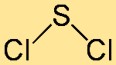
La structure du chlorure de soufre est mieux décrite comme une molécule courbée ou en forme de V. Il est constitué d’un atome central de soufre lié à deux atomes de chlore. La disposition des atomes et leurs angles de liaison contribuent à la stabilité globale et à la réactivité du composé.
Solubilité du dichlorure de soufre
Le chlorure de soufre présente une solubilité limitée dans l’eau. Il est peu soluble et a tendance à former une solution trouble lorsqu’il est mélangé à de l’eau. Les caractéristiques de solubilité du composé sont importantes à prendre en compte pour déterminer sa compatibilité avec d’autres substances et son comportement dans différents solvants.
| Apparence | Liquide jaune |
| Gravité spécifique | 1,64 g/ml |
| Couleur | Jaune |
| Odeur | Âcre |
| Masse molaire | 102,91 g/mole |
| Densité | 1,64 g/ml |
| Point de fusion | -76,8 °C |
| Point d’ébullition | 138,8 °C |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans l’acide acétique glacial, le benzène, le brome |
| Pression de vapeur | 35,4 mmHg |
| Densité de vapeur | 3,9 (air=1) |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du dichlorure de soufre
Le chlorure de soufre présente plusieurs risques pour la sécurité et doit être manipulé avec prudence. Il est très corrosif et peut provoquer de graves brûlures au contact de la peau, des yeux ou des muqueuses. L’inhalation de ses vapeurs peut irriter le système respiratoire et entraîner de la toux, des difficultés respiratoires et des lésions pulmonaires. Il est également inflammable et peut s’enflammer en présence de certaines substances. Lorsque vous travaillez avec du chlorure de soufre, des équipements de protection appropriés tels que des gants, des lunettes et une protection respiratoire doivent être utilisés. Il est essentiel de manipuler et de stocker ce composé dans un endroit bien ventilé, loin des sources d’inflammation et des matériaux incompatibles, afin d’éviter les accidents et les dommages potentiels.
| Symboles de danger | Corrosif |
| Description de la sécurité | Évitez tout contact, portez un équipement de protection, travaillez dans des zones bien ventilées |
| Numéros d’identification de l’ONU | ONU 1828 |
| Code SH | 2812.10.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du dichlorure de soufre
Il existe plusieurs méthodes pour synthétiser le chlorure de soufre. Une approche courante implique la réaction entre le soufre et le chlore gazeux. Dans ce processus, un excès de chlore est présent lors du chauffage du soufre à une température spécifique, généralement autour de 200-250 °C (392-482 °F). La réaction se déroule pour former du chlorure de soufre.
Une autre méthode implique la réaction entre le chlorure de thionyle (SOCl₂) et le soufre. Le chlorure de thionyle agit comme une source de chlore, qui réagit avec le soufre pour produire du chlorure de soufre. Cette réaction se produit à une température relativement plus basse que la méthode directe soufre-chlore.
La réaction entre le chlorure de sulfuryle (SO₂Cl₂) et l’hydrogène sulfuré (H₂S) permet la préparation de chlorure de soufre. Cette réaction se produit à des températures élevées et produit du chlorure de soufre ainsi que d’autres sous-produits.
Pour garantir la sécurité du personnel impliqué, il est crucial de réaliser la synthèse du chlorure de soufre dans des laboratoires ou des milieux industriels bien équipés. Le personnel doit suivre les mesures de sécurité appropriées, notamment en portant un équipement de protection et en travaillant dans des zones bien ventilées, en raison de la nature dangereuse du composé.
Le choix de la méthode de synthèse dépend de divers facteurs, notamment de la disponibilité des matières premières, de la pureté souhaitée du produit et des exigences spécifiques de l’application. La sélection de la technique appropriée dépend des besoins spécifiques du processus ou de l’application, car chaque méthode présente ses propres avantages et considérations.
Utilisations du dichlorure de soufre
Le chlorure de soufre (SCl₂) trouve des applications dans diverses industries et procédés en raison de ses propriétés spécifiques. Voici quelques utilisations clés du chlorure de soufre :
- Fabrication de colorants : les fabricants utilisent du chlorure de soufre pour produire des colorants, en particulier des colorants au soufre, qui confèrent des couleurs éclatantes aux tissus de l’industrie textile.
- Industrie du caoutchouc : L’industrie du caoutchouc utilise le SCl₂ comme agent de vulcanisation pour améliorer la résistance et l’élasticité des produits en caoutchouc en réticulant les chaînes polymères.
- Synthèse des pesticides : Le chlorure de soufre joue un rôle crucial dans la synthèse de certains pesticides, permettant la production d’insecticides et de fongicides appelés composés organophosphorés et organothiophosphates.
- Synthèse chimique : SCl₂ sert de réactif polyvalent dans diverses réactions chimiques, permettant des réactions de chloration telles que la conversion d’alcools en chlorures d’alkyle ou la synthèse de composés organiques chlorés.
- Réactif de laboratoire : les laboratoires utilisent le chlorure de soufre comme réactif pour de multiples applications, notamment la synthèse organique, la chimie du soufre et les réactions inorganiques.
- Traitement de l’eau : les processus de traitement de l’eau utilisent le SCl₂ comme agent désinfectant et oxydant pour éliminer les micro-organismes nocifs et les polluants organiques des sources d’eau.
- Industrie pharmaceutique : Le chlorure de soufre trouve des applications dans la recherche et le développement pharmaceutique, notamment dans la synthèse de certains ingrédients pharmaceutiques actifs (API).
- Analyse chimique : les techniques de chimie analytique, telles que la chromatographie en phase gazeuse, utilisent le SCl₂ pour détecter et analyser des composés spécifiques.
Ces diverses applications mettent en évidence l’importance du chlorure de soufre dans divers processus industriels et efforts scientifiques. Cependant, il est important de manipuler et d’utiliser le chlorure de soufre avec précaution, en respectant les directives et procédures de sécurité appropriées en raison de sa nature dangereuse.
Des questions:
Q : Quelle est la formule du dichlorure de soufre ?
R : La formule du chlorure de soufre est SCl₂.
Q : Quelle formule représente le composé moléculaire dichlorure de soufre ?
R : Le composé moléculaire chlorure de soufre est représenté par la formule SCl₂.
Q : Le dichlorure de soufre est-il polaire ?
R : Oui, le chlorure de soufre est polaire en raison de la présence d’une géométrie moléculaire courbée et de la répartition inégale de la densité électronique.
Q : Quelles orbitales atomiques ou hybrides constituent la liaison sigma entre S et Cl dans le dichlorure de soufre, SCl₂ ?
R : La liaison sigma entre le soufre (S) et le chlore (Cl) dans le chlorure de soufre (SCl₂) est formée par le chevauchement de l’orbitale 3p du soufre et de l’orbitale 3p du chlore.
Q : Le SCl₂ est-il linéaire ?
R : Non, le chlorure de soufre (SCl₂) n’est pas linéaire. Il a une géométrie moléculaire courbée ou en forme de V.
Q : Lequel des éléments suivants est un composé ionique ? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
R : Aucun des composés répertoriés n’est un composé ionique. Il s’agit soit de composés moléculaires (Cl₂O, CH₂O, SCl₂, PF₅), soit d’un composé phosphaté inorganique (Mg₃(PO₄)₂).
Q : Quel est le nom du composé de formule SCl₂ ?
R : Le composé de formule SCl₂ est appelé chlorure de soufre.
Q : Quelle est la forme de SCl₂ ?
R : SCl₂ a une forme moléculaire courbée ou en forme de V.
Q : Quelle est la géométrie moléculaire du SCl₂ ?
R : La géométrie moléculaire du SCl₂ est courbée ou en forme de V.
Q : Quel est le nom des orbitales hybrides utilisées par le soufre dans SCl₂ ?
R : L’atome de soufre dans SCl₂ utilise des orbitales hybrides sp².
Q : Que se passe-t-il lorsqu’un atome de soufre se combine à deux atomes de chlore pour produire du SCl₂ ?
R : Lorsqu’un atome de soufre se combine avec deux atomes de chlore, il forme le composé SCl₂, connu sous le nom de chlorure de soufre. L’atome de soufre partage des électrons avec les atomes de chlore pour créer une liaison covalente entre eux.
